
| A、5% | B、80% |
| C、83% | D、91% |
| x 2 |
| (0.2-x)×(1-x) |
| 1 |
| 6 |
| ||
| 0.2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
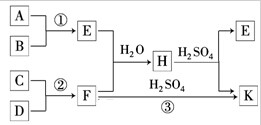
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
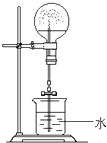 某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.
某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学受2Mg+CO2
某同学受2Mg+CO2
| ||
| 实验操作 | 预期现象 | 结论 |
| (1)取少许反应后试管C中的溶液,加入足量的BaCl2溶液 | 无白色沉淀产生 | 证明假设 |
| (2)若有白色沉淀产生,再检测(1)的上层溶液的PH | 若PH>7 | 则溶液中溶质是 |
| 若PH=7 | 则溶液中溶质是 | |
| 若PH<7 | 则溶液中溶质是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:
实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量粗盐 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com