
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2﹣CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( ) 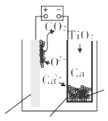
A.由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子
B.阳极的电极反应式为 C+2O2﹣﹣4e﹣═CO2↑
C.在制备金属钛前后,整套装置中 CaO 的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min达平衡,测得平衡时A为1.2 mol ,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变
D.A的消耗速率与B的消耗速率之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学科学的发展说法中,不正确的是
A.1777年,法国科学家拉瓦锡提出氧化学说
B.1811年,意大利科学家阿伏伽德罗提出原子学说
C.1965年,我国化学家合成了牛胰岛素,首次实现了蛋白质的人工合成
D.2015年,我国科学家屠呦呦因发现青蒿素而获得诺贝尔生理学或医学奖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃铬渣对人体以及环境危害极大,铬渣含有Na2SO4及少量Cr2O72-、Fe3+;某工厂从铬渣中提取硫酸钠的工艺如图1:
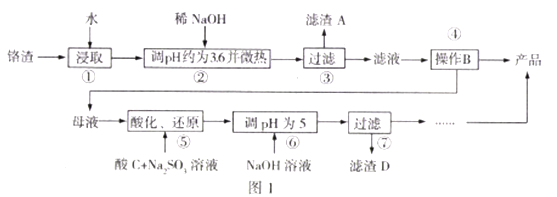
己知:I.Fe3+、Cr3+完全沉淀(c≦1.0×10-5mol/L)时pH分别为3.6和5;
Ⅱ.Cr2O72-还原产物为Cr3+。
(1)步骤2调节pH=3.6的目的为______,“微热”的作用为_______。
(2)Na2SO4和Na2Cr2O7的溶解度随温度变化曲线如图2,操作B的方法为_________.
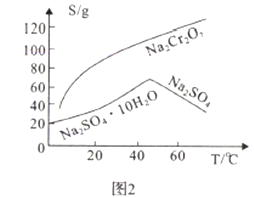
A.蒸发结晶、趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)步骤5中酸C不能选择硝酸的理由为____________,酸化、还原过程发生反应的离子方程式为_______,若将该反应设计为原电池(惰性电极),则负极的电极反应式为_______。
(4)Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=_______
(5)为了测定步骤3的滤液中Na2Cr2O7的浓度,进行步骤如下:
I.取100mL滤液;
Ⅱ.用cmol/L的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液;则步骤3的滤液中Na2Cr2O7的含量为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯气的叙述中正确的是
A.铜丝在氯气中燃烧,生成蓝绿色的氯化铜
B.氯气、液氯和氯水都是纯净物,都有漂白性
C.氯气的性质活泼,它与氢气混合后立即发生爆炸
D.除去Cl2中的HCl气体,可将混合气体通入饱和食盐水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 在玉米植株中,P既是必需元素也是大量元素
B. 细胞中的线粒体、内质网、液泡、高尔基体等细胞器都含有P元素
C. P元素参与构成生物体内的各种化合物,如磷脂、RNA、脂肪等
D. P在维持叶绿体膜的结构与功能上有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )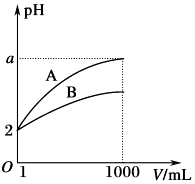
A.A,B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若a小于5,则A,B都是弱酸,且A的酸性弱于B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com