
【题目】在某温度时,将n molL-1氨水滴入10mL1.0 molL-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如右图所示,下列有关说法正确的是( )
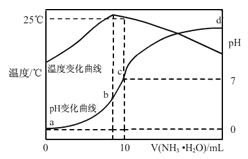
A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-)
D. 25℃时NH4Cl水解常数为(n-1)×10-7molL-1(用n表示)
【答案】D
【解析】试题分析:将n molL-1氨水滴入10mL1.0 molL-1盐酸中,发生反应:NH3·H2O+HCl==NH4Cl+H2O 。A、水的电离为吸热过程,升高温度促进电离,Kw增大,由图像知a点温度低于25℃,故Kw<1.0×10-14,错误;B、根据图像知b点溶液的温度最高,氨水和盐酸恰好完全反应,所得溶液为氯化铵溶液,水的电离程度最大,a点溶液为盐酸,抑制水的电离,d点溶液为氯化铵和氨水的混合物,抑制水的电离,d点pH未知,a、d两点温度不同,a、d两点水的电离程度无法比较,错误;C、根据图像知b点溶液的温度最高,氨水和盐酸恰好完全反应,所得溶液为氯化铵溶液,铵离子水解,离子浓度关系为C(Cl-) >C(NH4+) > C(H+) > C(OH-),错误;D、根据图像知25℃时溶液的pH=7,c(H+)=c(OH-)=1×10-7mol/L,结合电荷守恒知c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒知c(NH3·H2O)=0.5(n-1)mol/L,NH4Cl水解常数为Kh= c(H+) c(NH3·H2O)/ c(NH4+)=(n-1)×10-7molL-1,正确。


科目:高中化学 来源: 题型:
【题目】吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。科学家尝试用Na2SeO3消除人体内的活性氧,则在此过程中Na2SeO3的作用是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.以上均不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中
B. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C. 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称
D. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置检验乙烯时不需要除杂的是 ( )
乙烯的制备 | 试剂X | 试剂Y |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓H2SO4加热至170℃ | 资*源%库NaOH溶液 | KMnO4酸性溶液 | |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A.OC段离子反应方程式:H++OH-=H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(![]() )=0.012 mol
)=0.012 mol
D.欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用或事实与胶体的性质没有关系的是
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____不成立,写出产生上述气体的化学方程式___________________。
步骤二:取少量步骤一溶液置于试管中滴加_______,振荡,若________,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立。
方案三:

同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________(填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____(结果保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气②煤③核能④水力发电⑤太阳能⑥燃料电池⑦风能⑧氢能
A. ①②③④ B. ③⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com