
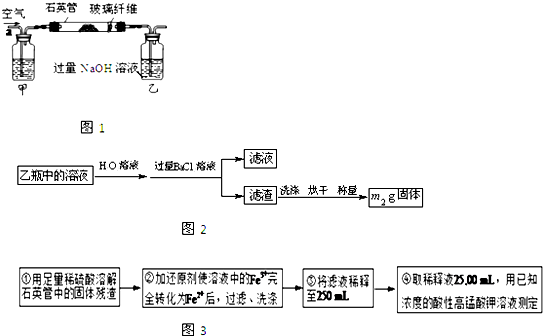
| ||
| m2 |
| 233 |
| ||
| m1 |
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |


科目:高中化学 来源: 题型:
| A、对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 |
| B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C、在一定条件下,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol |
D、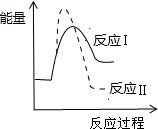 已知某物质在一定条件下可发生两个化学反应,反应过程中的总能量变化如图所示,由图示可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,且反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
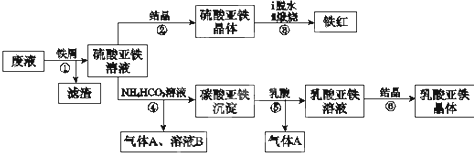
查看答案和解析>>
科目:高中化学 来源: 题型:
| 8 |
| 30 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操 作 | 现 象 |
| (1) | 取少许溶液向其中滴加稀盐酸 | 有气泡产生 |
| (2) | 另取少许溶液向其中滴加氯水,及CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、可能含有的离子是①⑥ |
| D、不能确定的离子是③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④ |
| C、②③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com