
自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是( )
A、NaIO3是氧化剂, HSO3-是还原剂
B、生产中可得到副产物H2SO4和Na2SO4
C、I2既是氧化产物又是还原产物
D、HSO3-的还原性比I-弱
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。

①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为
0.25 mol/L)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,在一定条件下,用CH4还原NOX可以消除氮氧化物的污染。
 例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
写出CH4还原N2O4(g)生成N2和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放目的。通过人工光合作用,以CO2和H2O为原
料可以制备HCOOH和O2,计算标况下每回收1.0m3 CO2转移的电子数为 个。
③常温下,0.1mol/L的HCOONa溶液的pH为10,则HCOOH的电离常数Ka = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3。其中HNO3为反应物,则该氧化还原反应中的还原剂为 ( )
A.NO B.FeSO4 C.Fe(NO3)3 D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
下列判断不正确的是 ( )
A.实验①反应后的溶液中:c(K+) > c(A-) > c(OH-) > c(H+)
B.实验①反应后的溶液中:c(OH-) = c(K+) — c(A-) =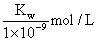
C.实验②反应后的溶液中:c(A-) + c(HA) > 0.1mol/L
D.实验②反应后的溶液中:c(K+) = c(A-) > c(OH-) = c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
在同一溶液中,含有NH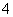 、I-、Ba2+、Cl-等离子,则该溶液可能的pH和介质是
、I-、Ba2+、Cl-等离子,则该溶液可能的pH和介质是
A.pH=1,稀硝酸为介质 B.pH=3,硫酸为介质
C.pH=8,次氯酸钠溶液为介质 D.pH=12,氨水为介质
查看答案和解析>>
科目:高中化学 来源: 题型:
两位同学根据电解原理,利用塑料瓶、9 V电池、大头针进行电解污水的实验。实验装置如下图。

根据上图回答下列问题:
(1)根据电浮选凝聚法处理污水的净化原理写出阳极区和阴极区上各自的电极反应式:
阳极:_________________________________________________;
阴极:______________________________________________。
(2)试分析不能参加反应的污物是如何沉淀的:______________________________________________。
(3)最后悬浮物为什么会形成浮渣:_______________________________________________。
(4)甲同学模拟该原理进行污水处理实验,在电压符合要求的情况下,发现产生气泡速度缓慢,无法使悬浮物形成浮渣。其原因是______________________________________________。
乙同学为甲同学提出一种切实可行的解决措施是向污水中加入适量的__________溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com