
【题目】能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
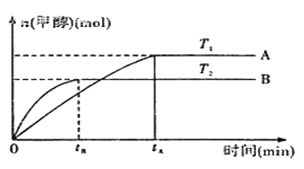
①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。
②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。
【答案】CH4 (g)+ 2O2(g)![]() CO2(g)+2H2O(l) △H=-890.31kJ/mol <
CO2(g)+2H2O(l) △H=-890.31kJ/mol < ![]() <
<
【解析】
(1)甲烷燃烧热是1mol甲烷燃烧生成二氧化碳和液态水放出的热量,依据热化学方程式书写方法标注聚集状态和对应焓变;(2) ①根据 “先拐先平”,可知T1<T2,升高温度后,甲醇的含量减小,平衡逆向移动;②根据平衡常数定义书写表达式;焓变<0,升高温,平衡逆向移动。
(1)甲烷燃烧热是1mol甲烷燃烧生成二氧化碳和液态水放出的热量,由题中信息可知,甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol;(2) ①根据 “先拐先平”,可知T1<T2,升高温度后,甲醇的含量减小,平衡逆向移动,所以合成甲醇反应的△H<0;②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)平衡常数的表达式为
CH3OH(g)+H2O(g)平衡常数的表达式为![]() ;T1<T2,焓变小于0,升高温,平衡逆向移动,K减小,所以T2时的平衡常数< T1时的平衡常数。
;T1<T2,焓变小于0,升高温,平衡逆向移动,K减小,所以T2时的平衡常数< T1时的平衡常数。


科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式____________.
(2)B元素在周期表中的位置____________;离子半径:B____________A(填“大于”或“小于”).原子半径:B____________C(填“大于”或“小于”).
(3)C原子的电子排布图是____________,其原子核外有____________个未成对电子,能量最高的电子为____________轨道上的电子,其轨道呈____________形.
(4)D﹣的结构示意图是____________.第一电离能D____________A(填“大于”或“小于”).
(5)C单质中的化学键为____________(填“极性键”或“非极性键”),1molC的气态氢化物中含有____________molσ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
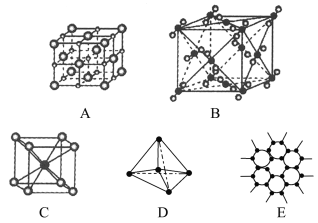
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是________,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,A元素的原子核外有两个电子层,最外层已达到饱和,B元素位于A元素的下一周期,最外层的电子数是A元素最外层电子数的![]() ,C元素的离子带有两个单位正电荷,它的核外电子排布与A元素原子相同,D元素与C元素属同一周期,D元素原子的最外层电子数比C的最外层电子数少1。
,C元素的离子带有两个单位正电荷,它的核外电子排布与A元素原子相同,D元素与C元素属同一周期,D元素原子的最外层电子数比C的最外层电子数少1。
根据上述内容判断
(1)A______、B______、C______、D______(填元素符号)。
(2)B元素位于第_______周期_______族,B的最高价氧化物的化学式是______,其最高价氧化物的水化物是一种______酸(填强或弱)。
(3)在C与D的单质中,与冷水反应较剧烈的反应的离子方程式是______。
(4)C离子的核外电子排布式为______;D原子的核外电子排布式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变时,只改变某一条件,化学反应aA(g)+B(g)![]() cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是

A. 在图象反应Ⅰ中,说明正反应为吸热反应
B. 在图象反应Ⅰ中,若p1>p2,则此反应的ΔS>0
C. 在图象反应Ⅱ中,说明该正反应为吸热反应
D. 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒的味道主要来自辣椒素类化合物。一种合成辣椒素中间体![]()
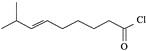
![]() 的合成路线如下:
的合成路线如下:
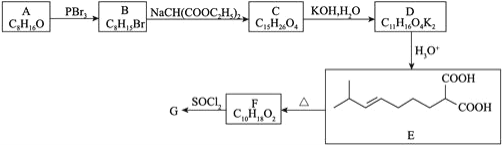
回答下列问题:
![]() 中所含官能团的名称为_____________。
中所含官能团的名称为_____________。
![]() 的结构简式为______________________。
的结构简式为______________________。
![]() 、
、![]() 的反应类型分别是______________、______________。
的反应类型分别是______________、______________。
![]() 的化学方程式为___________________________。
的化学方程式为___________________________。
![]() 满足下列条件的E的同分异构体有________种
满足下列条件的E的同分异构体有________种![]() 不考虑立体异构
不考虑立体异构![]() 。
。
![]() 含有一个六元碳环
含有一个六元碳环![]() 环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
![]() 参照上述合成路线,以1,
参照上述合成路线,以1,![]() 丁二烯和
丁二烯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备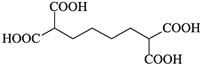 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是分子式为![]() 的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为
的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为![]() ,有如图所示的转化:
,有如图所示的转化:

已知:
![]() 含羰基的化合物均能与格氏试剂发生如下反应:
含羰基的化合物均能与格氏试剂发生如下反应:![]()
![]()
![]()
![]() 两个羟基连在同一碳原子上极不稳定,易脱水:
两个羟基连在同一碳原子上极不稳定,易脱水: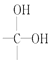 →
→![]() +H2O
+H2O
根据以上信息,回答下列问题:
![]() 写出化合物D中官能团的名称________。
写出化合物D中官能团的名称________。
![]() 写出化合物B、F的结构简式________、________。
写出化合物B、F的结构简式________、________。
![]() 的反应类型是________。
的反应类型是________。
![]() 写出D与
写出D与![]() 反应的化学方程式________________
反应的化学方程式________________![]() 写出
写出![]() 的化学方程式_______________________。
的化学方程式_______________________。
![]() 的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。
的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。![]() 不考虑立体异构
不考虑立体异构![]()
![]() 含有两个取代基
含有两个取代基 ![]() 苯环上的一氯代物只有两种
苯环上的一氯代物只有两种 ![]() 能与足量金属钠反应生成
能与足量金属钠反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )
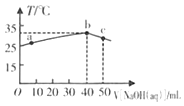
A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com