
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
分析 A.依据n=$\frac{m}{M}$质量转化为物质的量;
B.根据物质的量浓度公式n=CV计算;
C.依据n=$\frac{m}{M}$质量转化为物质的量;
D.依据n=$\frac{V}{Vm}$计算.
解答 解:A.1.6 g CH4物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,含有6.02×1022个分子,故A错误;
B.根据物质的量浓度公式:n(硫酸)=c•v=1 mol/L×0.1L=0.1mol,所以n(H+)=0.2mol,氢离子数目为1.204×1023,故B错误;
故B错误;
C.2.4gMg物质的量为$\frac{2.4g}{24g/mol}$=0.1mol,含有的原子数,6.02×1022个,故C错误;
D.标准状况下,22.4LCO气体物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,含有的分子数6.02×1023,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,明确好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
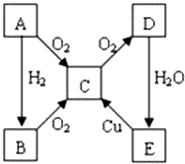 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.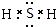 ;
;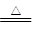 CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.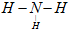 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
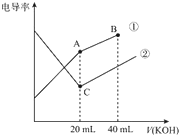
| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 | |
| B. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| C. | 漂白粉在空气中变质是因为CaCl2与空气中的CO2反应生成 CaCO3 | |
| D. | 用热的纯碱溶液洗去油污是因为Na2CO3可直接与油脂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com