
相关数据如下表

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其它相关数据如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
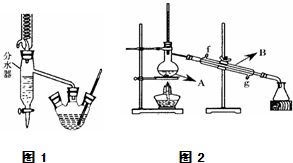 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 | B、224.0 |
| C、518.8 | D、494 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| Ⅰ | Fe(s)+CO2?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)?CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)? FeO(s)+H2(g) |
K3 | a | 1.68 |
| A、a>b |
| B、增大压强;平衡状态II不移动 |
| C、升高温度平衡状态Ⅲ向正反应方向移动 |
| D、反应Ⅱ,Ⅲ均为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com