
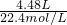 =0.2mol,无论硝酸被还原成一氧化氮还是二氧化氮,根据氮原子守恒知,被还原的硝酸与气体物质的量之比为1:1,所以被还原的硝酸的物质的量是0.2mol,故答案为0.2mol;
=0.2mol,无论硝酸被还原成一氧化氮还是二氧化氮,根据氮原子守恒知,被还原的硝酸与气体物质的量之比为1:1,所以被还原的硝酸的物质的量是0.2mol,故答案为0.2mol; 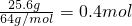 ,50mL 12mol/L的硝酸的物质的量=12mol/L×0.05L=0.6mol,由(1)知被还原的硝酸的物质的量是0.2mol,所以剩余硝酸0.6mol-0.2mol=0.4mol,如果铜完全被氧化成铜离子,生成硝酸铜需要硝酸的物质的量(起酸作用的硝酸的物质的量)为0.4mol×2=0.8mol>0.4mol,所以铜剩余.
,50mL 12mol/L的硝酸的物质的量=12mol/L×0.05L=0.6mol,由(1)知被还原的硝酸的物质的量是0.2mol,所以剩余硝酸0.6mol-0.2mol=0.4mol,如果铜完全被氧化成铜离子,生成硝酸铜需要硝酸的物质的量(起酸作用的硝酸的物质的量)为0.4mol×2=0.8mol>0.4mol,所以铜剩余. 起酸作用的硝酸的物质的量=
起酸作用的硝酸的物质的量=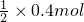 =0.2mol,所以还剩余铜0.4mol-0.2mol=0.2mol.
=0.2mol,所以还剩余铜0.4mol-0.2mol=0.2mol.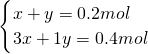
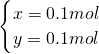
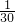 mol
mol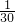 )mol×22.4L/mol=2.99L,
)mol×22.4L/mol=2.99L,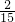 mol 2.99L
mol 2.99L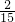 mol<0.4mol,所以硝酸过量,
mol<0.4mol,所以硝酸过量,

科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 22.4 |
| 1 |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 4NO+6H2O
4NO+6H2O 4NO+6H2O
4NO+6H2O +HNO3(浓)
+HNO3(浓)| H2SO4(浓) |
| 50-60℃ |
 -NO2+H2O
-NO2+H2O +HNO3(浓)
+HNO3(浓)| H2SO4(浓) |
| 50-60℃ |
 -NO2+H2O
-NO2+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com