
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.分析 (1)根据CH3OH燃烧生成二氧化碳和液态水,所以根据盖斯定律还应该有生成二氧化碳和液态水的热化学方程式,因为CO的燃烧热△H为-283kJ•mol-1,则有生成二氧化碳,还要有生成液态水,则必须涉及氢气燃烧的反应,据此分析;
(2)①a、b、c、d、e五个恒容密闭容器,由图象可知对应温度依次升高,则反应速率也依次增大,由于c中水的体积分数最大,表明t1时刻d、e已处于平衡状态,a、b肯定没有达到平衡状态,c可能处于平衡状态;因为达到平衡后,升高温度水的体积分数反而减小,说明升高温度平衡向逆反应进行,据此判断;
②t1时刻时,a、e容器水的体积分数相等,说明a、e容器中反应物浓度相同,则温度越高正反应速率越大;
③根据K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2}){\;}^{3}}$结合三组量计算;
④根据欲提高H2的转化率,即在不改变氢气的量时使平衡正向移动即可;
(3)①某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则溶液酸碱性主要由CO32-+H2O?HCO3-+OH-,K=$\frac{c(HC{{O}_{3}}^{-})c(OH{\;}^{-})}{c(CO{{\;}_{3}}^{2-})}$
=$\frac{K{\;}_{w}}{K{\;}_{2}(H{\;}_{2}CO{\;}_{3})}$,据此计算出氢氧根离子浓度,从而求出pH;
②根据CaSO4难溶于酸难除去,而CaCO3易溶于酸中易除去分析.
解答 解:(1)欲求出CH3OH的燃烧热,根据CH3OH燃烧生成二氧化碳和液态水,所以根据盖斯定律还应该有生成二氧化碳和液态水的热化学方程式,又已知CO的燃烧热△H为-283kJ•mol-1,即CO (g)+$\frac{1}{2}$O2 (g)?CO2(g)△H=-283kJ•mol-1;那还必须有生成液态水的热化学方程式,则需要知道一个H2 (g)燃烧的热化学方程式,所以该反应的热化学方程式为2H2 (g)+O2 (g)?2H2O(l)△H,故答案为:2H2 (g)+O2 (g)?2H2O(l)△H;
(2)①a、b、c、d、e五个恒容密闭容器,由图象可知对应温度依次升高,则反应速率也依次增大,由于c中水的体积分数最大,表明t1时刻d、e已处于平衡状态,a、b肯定没有达到平衡状态,c可能处于平衡状态;又因为达到平衡后,升高温度水的体积分数反而减小,说明升高温度平衡向逆反应进行,则正反应为放热反应,即△H<0,故答案为:<;a、b;
②t1时刻时,a、e容器水的体积分数相等,说明a、e容器中反应物浓度相同,又e容器温度大于a,所以容器a中正反应速率小于容器e中正反应速率,故答案为:小于;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 3mol 7mol 0 0
转化 x 3x x x
平衡3-x 7-3x x x
根据Td℃时,平衡水的体积分数为$\frac{1}{3}$,所以$\frac{x}{3-x+7-3x+x+x}$=$\frac{1}{3}$,解得x=2,
则根据K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2}){\;}^{3}}$=$\frac{2×2}{1×1{\;}^{3}}$=4,故答案为:4;
④根据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)为体积减小的放热反应,所以欲提高H2的转化率,可以降低温度或者增大二氧化碳的量或者增大压强,故答案为:降低温度或者增大二氧化碳的量或者增大压强;
(3)①某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则溶液酸碱性主要由CO32-+H2O?HCO3-+OH-,K=$\frac{c(HC{{O}_{3}}^{-})c(OH{\;}^{-})}{c(CO{{\;}_{3}}^{2-})}$
=$\frac{K{\;}_{w}}{K{\;}_{2}(H{\;}_{2}CO{\;}_{3})}$,所以c(OH-)=$\frac{1×10{\;}^{-14}}{2×5×10{\;}^{-11}}$=10-4,则pH=-lgc(H+)=10,故答案为:10;
②因为CaSO4难溶于酸难除去,而CaCO3易溶于酸中易除去,所以在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,故答案为:CaSO4难溶于酸,而CaCO3易溶于酸中.
点评 本题考查了盖斯定律的应用、平衡状态的判断、平衡常数的计算以及离子浓度的计算等知识,本题的难点在于对图中平衡的判断,在达到最高点之前是建立平衡的过程,在最高点之后是受温度影响,平衡移动的过程,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
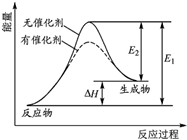 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能改变反应的路径,降低反应所需的活化能 | |
| D. | △H=E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉身碎骨浑不怕,要留清白在人间 | B. | 曾青得铁则化为铜 | ||
| C. | 春蚕到死丝方尽,蜡炬成灰泪始干 | D. | 水滴石穿 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com