

���� ��1����CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H=-574kJ•mol-1
��CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H=-1160kJ•mol-1
�����Ȼ�ѧ����ʽ��˹���ɼ��㣬��˹���ɣ���+�ڣ���$\frac{1}{2}$�õ�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽ��
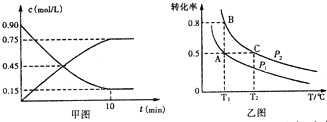
��2���ٸ���ͼ�����״���Ũ�ȱ仯ֵ���ٸ���v��CH3OH��=$\frac{��c}{t}$��Ȼ���ϼ�������ϵ����������Ũ�ȣ��ȸ���ƽ��Ũ�ȼ���ƽ�ⳣ��K��Ȼ�����K��Qc�Ĺ�ϵ�жϷ�Ӧ����
�������Ϸ�����ԭ��Ӧ��������������õ��ӣ���������������ˮ�����NaCl��Һ������Ӧ��2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2�����ڵ��һ��ʱ���NaCl��Һ��pH��Ϊ13����NaOHŨ��Ϊ0.1mol/L��������NaOHΪ0.3L��0.1mol/L=0.03mol��ȼ�ϵ���м״��������ɶ�����̼�����ݵ���ת���غ�������������ļ״������ʵ�����
���¶ȶ�ƽ���ƶ������Ӱ���жϷ�Ӧ�������仯����ͼ��֪��ߵ㷴Ӧ����ƽ�⣬����ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС�������¶�ƽ�����淴Ӧ���У��ݴ��жϣ�
��3����NH4��2SO4Ϊǿ�������Σ�ˮ�������ԣ�����NaOH��Һ����Һ�����ԣ����������غ�͵���غ���ʽ���ó�Na+��NH3•H2OŨ�ȵĹ�ϵ��
��� �⣺��1����CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H=-574kJ•mol-1
��CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H=-1160kJ•mol-1
�ɸ�˹���ɣ���+�ڣ���$\frac{1}{2}$�õ�CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H=-867kJ•mol-1��
�ʴ�Ϊ��CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H=-867kJ•mol-1��
��2���ٸ���ͼ���֪�״���Ũ�ȱ仯ֵΪ0.75mol/L����v��CH3OH��=$\frac{��c}{t}$=$\frac{0.75mol/L}{10min}$=0.075mol/��L•min������v��H2��=3v��CH3OH��=0.075mol/��L•min����3=0.225mol•L-1•mm-1��
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����1 3 0 0
ת��Ũ�ȣ�mol/L����0.75 2.25 0.75 0.75
ƽ��Ũ�ȣ�mol/L����0.25 0.75 0.75 0.75
ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$=$\frac{0.75��0.75}{0.25��0.7{5}^{3}}$=$\frac{16}{3}$��
��10min�����¶Ȳ��䣬����ܱ��������ٳ���1mol CO2��g����1mol H2O��g������Qc=$\frac{0.75��1.75}{1.25��0.7{5}^{3}}$=2.49��K����Ӧδ����ƽ��״̬���������������ƶ���
�ʴ�Ϊ��0.225������
�������Ϸ�����ԭ��Ӧ��������������õ��ӣ���������������ˮ���缫��ӦʽΪ��O2+4 H++4 e-=2 H2O��
���NaCl��Һ������Ӧ��2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2�����ڵ��һ��ʱ���NaCl��Һ��pH��Ϊ13����NaOHŨ��Ϊ0.1mol/L��������NaOHΪ0.3L��0.1mol/L=0.03mol������������Ϊ0.015mol��ȼ�ϵ���м״��������ɶ�����̼�����ݵ���ת���غ㣬���������ļ״������ʵ���Ϊ$\frac{0.015mol��2}{6}$=0.005mol��
�ʴ�Ϊ��O2+4H++4e-=2 H2O��0.005mol��
����ͼ��֪��ߵ㷴Ӧ����ƽ�⣬��ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС��ƽ�����淴Ӧ���У������¶�ƽ�����ȷ�����У��淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ������
��3����NH4��2SO4Ϊǿ�������Σ�NH4+ˮ�������ԣ�NH4++H2O?NH3•H2O+H+
��NH4��2SO4����Һ�е���NaOH��Һ����Һ�����ԣ����ݵ���غ�ɵã�C��NH4+��+C��Na+��+C��H+��=C��OH-��+2C��SO42-�� ��
���������غ���ʽ�ɵã�C��NH4+��+C��NH4•H2O��=2C��SO42-�� ��
���٢��������ã�C��Na+��=C��NH4•H2O����
�ʴ�Ϊ��NH4++H2O?NH3•H2O+H+��=��
���� ���⿼�����Ȼ�ѧ����ʽ����д��ƽ����ƶ��Լ�ƽ�ⳣ���ļ��㡢ԭ��غ͵��ص����ݣ��ۺ��Խ�ǿ���ѶȽϴ�ע�����ƽ�ⳣ�����йؼ����Լ�ͨ��Qc��k���ж�ƽ���ƶ��ķ�����Ŀ�����ڿ���ѧ���ķ��������������������ۺ�Ӧ��������


 ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 mol•L-1 ��Na2SO4��Һ�к���4 NA��Na+ | |
| B�� | ������0.1 mol FeCl3�ı�����Һ��ε���������ˮ�У��õ�Fe��OH��3������ĿΪ0.1 NA | |
| C�� | �ڱ�״���£�11.2 L�����к���NA����ԭ�� | |
| D�� | 7.8 g Na2O2����������ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
 | 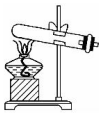 |  |  |
| ��Ϸ�Ӧ�� | ������������ | �ռ��������� | ������������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
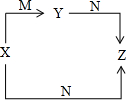 X��Y��Z��M��N���������У�X��Y��Z�о�������Ԫ�أ�X��M���dz����ĵ��ʣ�N��ˮ������֮�������ͼ��ʾ��ת����ϵ�������й����ʵ��ƶϲ���ȷ���ǣ�������
X��Y��Z��M��N���������У�X��Y��Z�о�������Ԫ�أ�X��M���dz����ĵ��ʣ�N��ˮ������֮�������ͼ��ʾ��ת����ϵ�������й����ʵ��ƶϲ���ȷ���ǣ�������| A�� | Xֻ���� | B�� | Yֻ��Na2O | C�� | Zֻ��NaOH | D�� | M������O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| CO | H2O | H2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ʵ������Ҫ0.1mol/L NaOH��Һ450mL��0.5mol/L��������Һ500mL��������������Һ����������ش��������⣮
ʵ������Ҫ0.1mol/L NaOH��Һ450mL��0.5mol/L��������Һ500mL��������������Һ����������ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ƿ��ԭ����������ˮ | |
| B�� | ��Һ���ձ�ת�Ƶ�����ƿ��û��ϴ���ձ� | |
| C�� | δ��ȴ������Һת�Ƶ�����ƿ | |
| D�� | ��ˮδ�ﵽ����ƿ�̶��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com