
能正确表示下列反应的离子方程式是( )
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH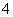 +SO
+SO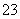 +H2O
+H2O
B.氯化钠与浓硫酸混合加热:H2SO4+2Cl-△,SO2↑+Cl2↑+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO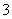 ===3Fe3++NO↑+3H2O
===3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO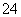 恰好完全沉淀:2Ba2++3OH-+Al3++2SO
恰好完全沉淀:2Ba2++3OH-+Al3++2SO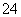 ===2BaSO4↓+Al(OH)3↓
===2BaSO4↓+Al(OH)3↓
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,18 g H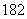 O含有的原子总数为3NA
O含有的原子总数为3NA
B.标准状况下,4.2 g CH2===CH2和CH3CH===CH2的混合气体中所含有的碳原子数为0.3NA
C.将0.1 mol Cl2通入1 L水中,转移的电子数目为0.1NA
D.0.1 mol·L-1Al2(SO4)3溶液中含有的Al3+总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应X+2Y===R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R,则在此反应中Y和M的质量比为( )
A.16∶9
B.23∶9
C.32∶9
D.46∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,抽去如图21所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是(设NA表示阿伏加德罗常数的值)( )
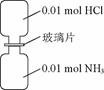
图21
A.气体反应物的总体积为0.448 L
B.装置中氢元素的总质量为0.04 g
C.生成物中含有0.01NA个分子
D.生成物完全溶于水后所得溶液含有0.01NA个NH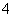
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
(1)aTiO2+bCl2+cC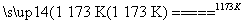 aTiCl4+cCO
aTiCl4+cCO
(2)TiCl4+2Mg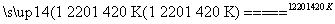 Ti+2MgCl2
Ti+2MgCl2
关于反应(1)、(2)的分析不正确的是
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,发生还原反应 ③每生成19.2 g Ti,反应(1)、(2)中共转移4.8 mol e- ④a=1,b=c=2
A.①②④ B.②③④
C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH |
| 阴离子 | Cl- CO |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是
___________________________________________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)金属性最强的是 _,化学性质最不活泼的是__________。
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________。(填化学式)
(3)⑧的原子结构示意图为_________________,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为___________。
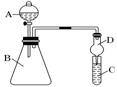 (4)若要证明非金属性:⑨>碘, 可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为___________,即可证明。
(4)若要证明非金属性:⑨>碘, 可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为___________,即可证明。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com