
分析 ①弱碱根离子结合水电离的氢氧根离子生成弱碱和氢离子;
②多元弱酸根离子的水解分步进行,主要以第一步为主.
解答 解:①若为强酸弱碱盐,An+水解生成A(OH)n和氢离子,其水解的离子方程式为:An++nH2O?A(OH)n+nH+,
故答案为:An++nH2O?A(OH)n+nH+;
②AmBn的溶液为弱酸强碱盐的溶液,多元弱酸根离子易水解且分步水解,其第一步水解的离子方程式为:Bm-+H2O?HB(m-1)-+OH-,
故答案为:Bm-+H2O?HB(m-1)-+OH-.
点评 本题考查了盐的水解原理原理及应用,题目难度中等,明确盐的水解原理为解答关键,注意掌握盐的水解反应的书写方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与过量二氧化碳反应:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3 Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中所含物质可能是纯净物 | |
| B. | 集气瓶中可能只含有两种单质 | |
| C. | 集气瓶中不可能既存在单质又存在化合物 | |
| D. | 集气瓶中可能含有一种单质和一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
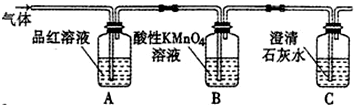
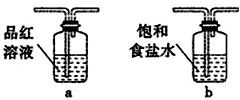
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
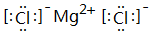 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.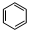 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$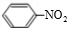 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com