
我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为______
(2)S与O为同主族元素,其中电负性较大的是____________;H2S分子中S原子杂化轨道类型为______;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_______。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成NH2-NH2,NH2—NH2能否作配体?______(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为______ ;欲比较CaO与NaCl的晶格能大小,需考虑的数据是______。
(1)3d34s2(2)O sp3 硫酸分子中的非羟基氧原子数比亚硫酸多(3)①能②4钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数
解析试题分析:(1)锰是25号元素,3d和4s上的电子是其价电子,根据构造原理知其价电子排布式为:3d34s2,故答案为:3d34s2;(2)同一主族中,元素的电负性随着原子序数的增大而减小,O元素的非金属性比S强,所以O元素的电负性大于S;H2S分子中S原子含有4个价层电子对,所以其杂化轨道类型为sp3,同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性;(3)①NH2-NH2中氮原子含有孤电子对,所以能作配体,故答案为:能;②一个CaO晶胞中含有Ca2+数=×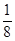 +6×
+6×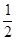 =4,晶格能和离子所带电荷成正比,与离子半径成反比,所以要比较钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数,故答案为:4;钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数.
=4,晶格能和离子所带电荷成正比,与离子半径成反比,所以要比较钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数,故答案为:4;钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数.
考点:原子核外电子排布;配合物的成键情况;原子轨道杂化方式及杂化类型判断


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
下图是元素周期表的框架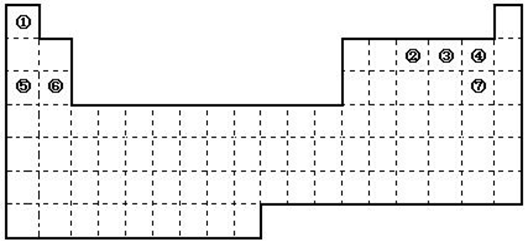
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是_________,E离子的电子排布式为____________,C原子的电子排布图为 ,D原子的原子结构示意图为_______ 。
(2)B的氢化物的沸点高于同主族元素氢化物的沸点,原因是_____________,该氢化物的电子式为_______,中心原子的杂化方式为 _______,分子的立体构型为_______。
(3)DCA与E的最高价氧化物的水化物相互反应的离子方程式 。
(4)根据对角线规则,Be与E性质相似,写出Be与DCA溶液反应的离子方程式______________________
(5)若要说明非金属元素X比元素Y(X、Y均为非稀有气体元素)的非金属性强,则下列方法正确的是__________(填序号)。
①X单质可以把Y从其氢化物中置换出来
②X原子的最外层电子数比Y原子的最外层电子数多
③X的氧化物的水化物的酸性比Y的氧化物的水化物的酸性强
④与H2化合时X单质比Y单质容易
⑤电负性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分短周期主族元素的有关信息,如下表:
| 元素编号 | T | X | Y | Z | W |
| 元素的性质或原子结构情况 | 短周期主族元素中原子半径最大 | 最外层上的电子数比次外层少1个且单质是气体 | 核外共有13种运动状态不同的电子 | 若低温蒸发液态空气,因其沸点较低可先获得它的单质 | 核外有5种不同能量的电子且其中有两个未成对的电子 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F周表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| A | A是周期表中原子半径最小的元素 |
| B | B元素的原子价电子排布为ns11np14 |
| C | M的基态原子L层电子数是K层电子数的3倍 |
| D | D是第三周期中第一电离能最小的元素 |
| E | E是地壳中含量最多的金属元素 |
| F | 有多种化合价,其某种高价阳离子的价电子具有较稳定的半充满结构 |
 键与
键与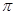 键与个数之比为 ;
键与个数之比为 ;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G元素原子序数依次增大。已知B原子最外层有3个未成对电子,C原子最外层电子数与核外电子总数之比为3:4,E与C同主族,F-、D+、A+离子的半径逐渐减小,化合物AF常温下为气体,G的基态原子核外M能层填满电子,N能层只有1个电子。
据此回答下列问题:
(1)写出D元素基态原子的核外电子排布式 ;B、C、E三种元素的第一电离能由大到小的顺序是(用元素符号表示)
(2)A与C可形成1 8电子分子,其水溶液中滴人少量氯化铁溶液时有大量气泡逸出,写出该反应的化学方程式
(3)某化合物由上述七种元素中的三种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为 ;该化合物水溶液不呈中性的原因是(用离子方程式表示) 。
(4)0.3molG的低价氧化物能与 molB的最高价氧化物对应水化物的溶液恰好完全反应(设还原产物只有BO)。
(5)卫星零射时可用B2A4为燃料,l mol气态B2A4在适量C2中燃烧,生成B2和气态A2C,放出534 kJ的热量,l mol液态A2C完全气化需吸收44 kJ热量。请写出气态B2A4在C2中燃烧生成B2和液态A2C时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
| | | A | |
| B | C | | D |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CaC2可用于固氮:CaC2+N2  CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。
(3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。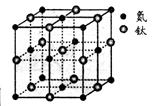
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com