
分析 由H2O2只发生如下过程H2O2-→O2可知,反应中过氧化氢为还原剂,氧气为氧化产物,则H2CrO4为氧化剂,对应产物Cr(OH)3为还原产物,结合氧化还原反应得失电子守恒及原子个数守恒书写方程式.
解答 解:由题意:H2O2只发生如下过程H2O2-→O2可知,反应中过氧化氢为还原剂,氧气为氧化产物,则H2CrO4为氧化剂,对应产物Cr(OH)3为还原产物,H2O2-→O2化合价升高2,H2CrO4→Cr(OH)3化合价降3,依据得失电子守恒,H2O2系数为3,依据原子个数守恒,H2CrO4系数为2,O2系数为3,Cr(OH)3系数为2,产物中生成2分子水,化学方程式为:3H2O2+2H2CrO4=2Cr(OH)3↓+3O2↑+2H2O;
故答案为:3H2O2+2H2CrO4=2Cr(OH)3↓+3O2↑+2H2O.
点评 本题考查了氧化还原反应方程式的配平,明确物质的性质,依据得失电子守恒、原子个数守恒即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| B. | 32g O2中含有的分子数为NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| D. | 1 L 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 不用催化剂,生成1molNH3放出的热量为46kJ,加入催化剂,生成1molNH3放出的热量为小于46kJ | |
| C. | 加入催化剂,降低了正反应的活化能,升高了逆反应的活化能 | |
| D. | 在温度、体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为Q1,若通入2molN2和6molH2,反应后放出的热量为Q2,则Q1<0.5Q2<92KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
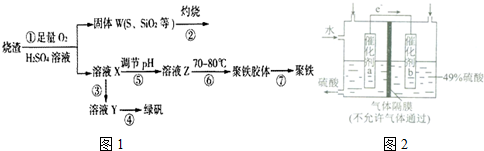
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下不容易自发进行 | B. | 升高温度,混合气体的密度增大 | ||
| C. | 压缩容器,反应吸收的热量不变 | D. | 分离出部分MgO,可增大CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
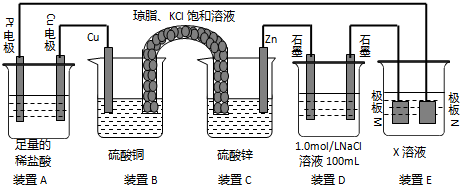
 请根据下图装置回答
请根据下图装置回答查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)═2Fe(OH)3+3H2 | |
| B. | 向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com