
分析 (1)根据反应物和生成物来书写化学方程式,并根据得失电子守恒来配平;
(2)化合价降低元素所在的反应物是氧化剂,AS4S4中化合价代数和这零来分析判断;
(3)根据化合价的升降以及物质的量的情况来计算转移电子的量;
(4)①甲烷碱性燃料电池中正极氧气得电子被还原,负极甲烷失电子被氧化;
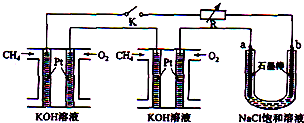
②b连接电源的负极,应为阴极,生成氢气,a连接正极,为阳极,阳极上生成氯气;电解氯化钠溶液生成氢气、氯气和氢氧化钠.
解答 解:(1)根据反应物和生成物:As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,可以得出化学方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,故答案为:2、2、4、1、2、2;
(2)化合价降低的As元素所在的反应物As2S3是氧化剂,对应产物As4S4中的硫是-2价,则As是+2价,故答案为:As2S3;+2;
(3)反应As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O中,若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol,故答案为:10mol;
(4)①在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:O2、CH4;2O2+4H2O+8e-=8OH-;CH4+10OH--8e-=CO32-+7H2O;
②b电极与通入甲烷的电极相连,作阴极,是H+放电,生成H2;a连接正极,为阳极,阳极上氯离子放电生成氯气,氯气能和碘离子发生置换反应生成碘单质,碘与淀粉试液变蓝色,所以检验氯气的方法是:把湿润的淀粉碘化钾试纸靠近a极,若试纸变蓝,说明得到的气体是Cl2;
电解氯化钠溶液的总反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:H2;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查学生氧化还原反应的基本概念和电子转移知识,电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,难度并不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
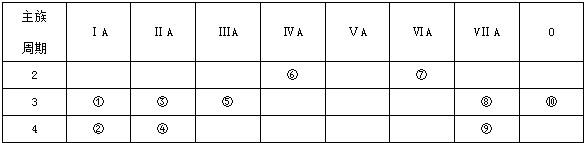
 ,用电子式表示⑦号元素氢化物的形成过程是
,用电子式表示⑦号元素氢化物的形成过程是 ,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.
,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
| D | 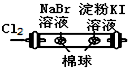 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性: Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
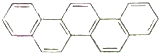 第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )
第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )| A. | 该有机物的一氯代物共有四种 | |
| B. | 该有机物是只含非极性键的非极性分子 | |
| C. | 该有机物属于芳香族化合物,是苯的同系物 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出各步反应的化学方程式.
,写出各步反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
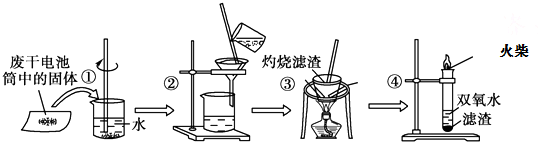
| A. | 步骤①②的名称分别为溶解、过滤 | |
| B. | 步骤③中使用的化学仪器有酒精灯、三角架、泥三角、坩埚、玻璃棒 | |
| C. | 步骤①②③中都使用了玻璃棒,且三个操作中玻璃棒的作用不完全相同 | |
| D. | 步骤④的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
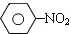 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$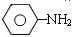 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)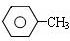 $\stackrel{KMnO_{4}、H+}{→}$
$\stackrel{KMnO_{4}、H+}{→}$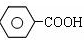
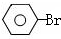 $→_{高温、加压}^{NaOH溶液、催化剂}$
$→_{高温、加压}^{NaOH溶液、催化剂}$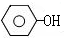
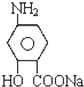 (对氨基水杨酸钠)
(对氨基水杨酸钠)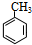 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$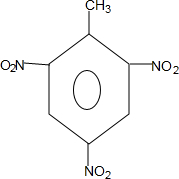 +3H2O
+3H2O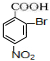 D:
D: ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com