
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 升高温度或使用催化剂是通过增加活化分子百分数而使反应速率加快 | |
| C. | 勒夏特列原理只使用于可逆反应,不使用于溶解和弱电解质的电离 | |
| D. | △G=△H-T△S适合任意条件的化学反应进行的方向判据 |
分析 A.正反应是放热反应的可逆反应,升高温度平衡逆向移动;
B.升高温度、加入催化剂都可增大活化分子百分数;
C.难溶电解质以及弱电解质都存在可逆过程;
D.△G=△H-T△S<0时可自发进行.
解答 解:A.正反应是放热反应的可逆反应,升高温度平衡逆向移动,则正反应速率小于逆反应速率,故A错误;
B.升高温度、加入催化剂都可增大活化分子百分数,可增大反应速率,故B正确;
C.难溶电解质以及弱电解质都存在可逆过程,适用于勒夏特列原理,故C错误;
D.△G=△H-T△S<0时可自发进行,温度、反应热以及熵变影响反应能否自发进行,故D错误.
故选B.
点评 本题考查较为综合,涉及化学平衡的影响因素以及反应热与焓变,为高频考点,侧重于双基的考查,注意把握外界条件下对平衡移动的影响,难度不大.


科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1 达平衡时,CO 的转化率为70% | |
| C. | 实验2 达平衡时,a<7.0 | |
| D. | 实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH) | |
| B. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 | |
| C. | 常温下将pH=3稀醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| D. | 25℃时,amol/L一元酸与bmol/LNaOH等体积混合后,pH=7,所得混合溶液中一定有c(A-)=c(NA+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液一定呈酸性 | |
| B. | c(H+)水电离产生=c(OH-)水电离产生的溶液一定呈中性 | |
| C. | 使石蕊试液显红色的溶液一定呈酸性 | |
| D. | 强酸和强碱等物质的量混合后溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O是一种纯净物 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| D. | SO3、NH3的水溶液均能导电,所以均是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
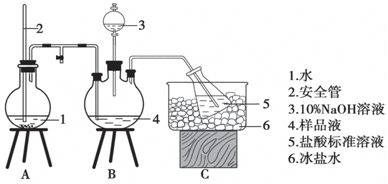 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com