
【题目】(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了_____________。稀释后还需要加入一些铁粉,其目的是____________,相关反应的离子方程式为__________________。
(2)氯化铁水溶液呈___________性,原因是(用离子方程式表示):________。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是_____________。
【答案】抑(防)止Fe2+水解 防止Fe2+被氧化成Fe3+ 2Fe3++ Fe = 3Fe2+ 酸性 Fe3++ 3H2O![]() Fe(OH)3 + 3H+ 氧化铁或Fe2O3 将三氯化铁溶液在HCl环境(或气氛)中加热蒸干
Fe(OH)3 + 3H+ 氧化铁或Fe2O3 将三氯化铁溶液在HCl环境(或气氛)中加热蒸干
【解析】
(1)Fe2+离子会发生水解,离子方程式为:Fe2++2H2O![]() Fe(OH)2+2H+,用浓盐酸溶解是为了抑(防)止Fe2+水解;又由于Fe2+离子易被氧气氧化生成Fe3+,所以加入铁粉是为了防止Fe2+被氧化成Fe3+:2Fe3++Fe=3Fe2+;
Fe(OH)2+2H+,用浓盐酸溶解是为了抑(防)止Fe2+水解;又由于Fe2+离子易被氧气氧化生成Fe3+,所以加入铁粉是为了防止Fe2+被氧化成Fe3+:2Fe3++Fe=3Fe2+;
(2)氯化铁水溶液呈酸性,原因是:Fe3++ 3H2O![]() Fe(OH)3 + 3H+;加热促进FeCl3的水解,HCl易挥发,把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3;要从氯化铁溶液得到纯氯化铁固体,应将三氯化铁溶液在HCl环境(或气氛)中加热蒸干。
Fe(OH)3 + 3H+;加热促进FeCl3的水解,HCl易挥发,把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3;要从氯化铁溶液得到纯氯化铁固体,应将三氯化铁溶液在HCl环境(或气氛)中加热蒸干。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
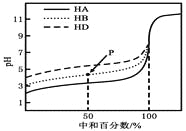
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的操作、现象以及所得出的结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A. | 把铝箔插入浓硝酸中 | 有大量红棕色气体产生 | 浓硝酸具有强氧化性 |
B. |
| 品红褪色 |
|
C. | 淀粉在酸催化水解后的溶液加入新制 | 无砖红色沉淀 | 淀粉水解产物不含葡萄糖 |
D. | 将充满 | 红棕色变深 | 反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在化工生产过程中有重要意义。如图所示是以烯烃A为原料合成粘合剂M的路线图。
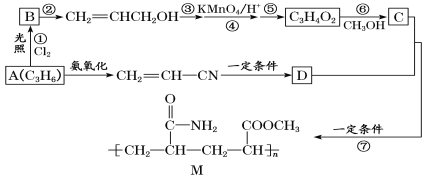
回答下列问题:
(1)下列关于路线图中的有机物或转化关系的说法正确的是__(填字母)。
a.A能发生加成反应、氧化反应、缩聚反应
b.B的结构简式为CH2ClCHClCH3
c.C的分子式为C4H5O3
d.M的单体是CH2=CHCOOCH3和![]()
(2)A分子中所含官能团的结构简式是__反应①的反应类型为__。
(3)设计反应③⑤的目的是__,C的名称为__。
(4)C和D生成M的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
①该溶液中除H2O的电离平衡外还存在的平衡体系是___。
②溶液中共有___种不同的微粒。
③这些粒子中浓度为0.01mol·L-1的是___,浓度为0.002mol·L-1的是___。
④物质的量之和为0.01mol的两种微粒是___。
(2)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
①已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1H2B溶液中c(H+)___(填“<”、“>”、“=”)0.11mol·L-1理由是___。
②0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
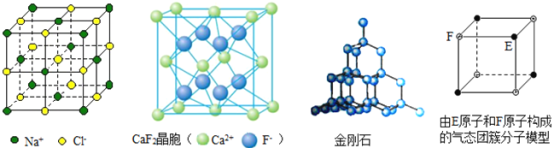
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氯化铁浸出一重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器搅拌30min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500mL,再移取100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
步骤6:重复测定两次,数据如下:
第一次 | 第二次 | 第三次 | |
消耗的K2Cr2O7标准溶液体积(mL) | 10.01 | 9.99 | 13.00 |
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为___,迅速塞上胶塞的原因是___。
(2)步骤3中判断滤纸上残渣已洗净的方法是___。
(3)实验中需用到100mL浓度约为0.01mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有___;称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是___(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于___(填仪器名称)中。
(4)利用上表数据,计算出该钛精粉试样中单质铁的质量分数为___(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
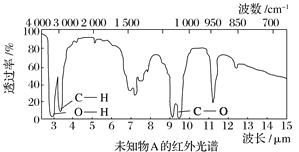
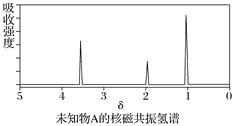
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )
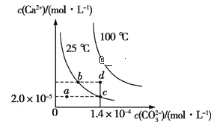
A.CaCO3(s)![]() Ca2+(aq)+CO32-(aq) ΔH<0
Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com