
| A. | 肯定有Na+、Al3+、Mg2+、SO42- | B. | 肯定有Na+、Mg2+、Al3+、Cl- | ||
| C. | 肯定没有Mg2+、HCO3-、MnO4-、Cl- | D. | 肯定没有K+、NH4+、Cl- |
分析 溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-、I-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+;则一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、I-、HCO3-.
解答 解:溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-、I-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+、;综上所述可知一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、I-、HCO3-.
A.由上述分析可知,一定不含镁离子,故A错误;
B.由上述分析可知,一定含有的离子为K+、NH4+、Al3+、SO42-,故B错误;
C.肯定没有Mg2+、HCO3-、MnO4-、Cl-,故C正确;
D.由电荷守恒可知,一定含K+,故D错误;
故选C.
点评 本题考查物质检验的实验方案的设计,为高频考点,把握实验中现象与结论的关系、发生的离子反应为解答的关键,注意电荷守恒的应用,题目难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | FeCl2 | C. | Na2O2 | D. | NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol溴苯中含有双键的数目为0.3NA | |
| B. | 1L 0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA | |
| C. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
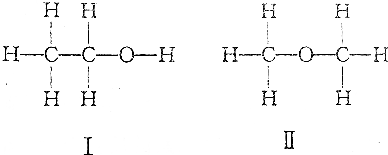
| A. | Ⅰ和Ⅱ是同分异构体 | B. | Ⅰ和Ⅱ物理性质有所不同 | ||
| C. | Ⅰ和Ⅱ化学性质相同 | D. | Ⅰ和Ⅱ含12C的质量分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
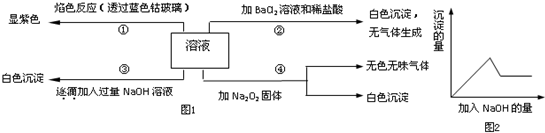
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 2 8.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
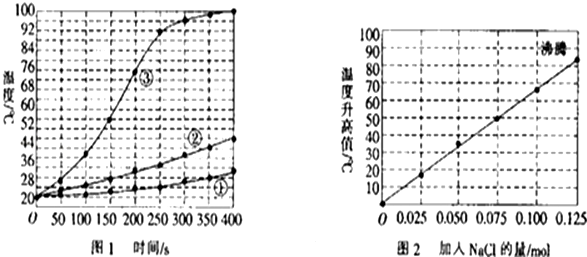
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com