
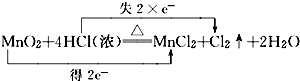 ,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol
,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol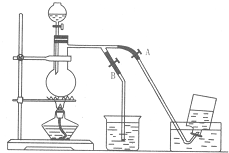
分析 (1)烧瓶内发生反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据元素化合价比较标出转移电子与数目,计算氯气的物质的量,结合方程式中转移数目计算转移电子物质的量;
(2)由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知87g二氧化锰与146gHCl恰好完全反应,但随着反应的进行,盐酸的浓度减小,反应不再进行,①中HCl不能完全反应,②中二氧化锰完全反应;
(3)氯气有毒,直接排放会污染空气,需要尾气处理,常用氢氧化钠溶液吸收;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气;
(4)在收集氯气之前,应打开B,关闭A,排尽装置内的空气,收集氯气时,应关闭B,打开A,用排饱和食盐水法收集;收集完毕,关闭A,打开B,用氢氧化钠溶液吸收多余氯气.
解答 解:(1)烧瓶内发生反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,标出电子转移与数目为: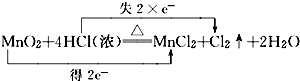 ,11.2L的Cl2(标准状况)的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,故转移电子为0.5mol×2=1mol,
,11.2L的Cl2(标准状况)的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,故转移电子为0.5mol×2=1mol,
故答案为: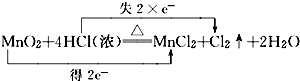 ;1mol;
;1mol;
(2)由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知87g二氧化锰与146gHCl恰好完全反应,但随着反应的进行,盐酸的浓度减小,反应不再进行,①中HCl不能完全反应,②中二氧化锰完全反应,故生成氯气的体积②>①,
故答案为:B;
(3)氯气有毒,可污染空气,要进行尾气吸收,常用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气;
故答案为:氢氧化钠溶液;吸收多余的氯气;Cl2+2OH-=Cl-+ClO-+H2O;饱和食盐水;
(4)在收集氯气之前,应打开B,关闭A,排尽装置内的空气,当氯气纯度合乎要求时,应打开A,关闭B,用排饱和食盐水法收集,但氯气收集完毕时,应关闭A,打开B,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气,
故答案为:打开B,关闭A;打开A,关闭B;关闭A,打开B.
点评 本题考查氯气制备、氧化还原反应等,注意利用单线桥与双线桥表示电子转移,注意注意浓盐酸与二氧化锰反应,随着反应的进行,盐酸的浓度减小,反应不再进行.


科目:高中化学 来源: 题型:选择题
| A. | 铁锈与稀硫酸 | |
| B. | FeCl3和CuCl2的混合溶液与过量铁粉 | |
| C. | 过量Fe0与稀硝酸 | |
| D. | FeS04酸性溶液与KN03溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | NH3•H2O═NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
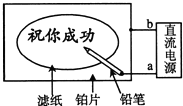 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生还原反应 | B. | 铂片端作阳极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3 | |
| B. | 相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 | |
| C. | 向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效 | |
| D. | 向浓度均为0.1 mol•L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com