
| A. | 牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 | |
| B. | AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同 | |
| C. | 室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
分析 A.牺牲阳极的阴极保护法为原电池反应;
B.AlCl3溶液在加热时生成氢氧化铝和盐酸,盐酸易挥发;
C.温度不变,则KW不变;
D.CO(g)的燃烧热是283.0kJ/mol,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283.0kJ/mol,以此可知2CO2(g)=2CO(g)+O2(g)反应的△H.
解答 解:A.应用电解原理防止金属的腐蚀为外加电源的阴极保护法,故A错误;
B.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,硫酸铝水解生成氢氧化铝和硫酸,加热促进硫酸铝水解,因为硫酸没有挥发性,所以得到的固体仍然是Al2(SO4)3,故B错误;
C.温度不变,则KW不变,故C错误;
D.CO(g)的燃烧热是283.0kJ/mol,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283.0kJ/mol,以此可知2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,故D正确.
故选D.
点评 本题考查较为综合,涉及化学反应与能量变化,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意盐类水解的原理是解答本题的关键,掌握常见化学物质的性质和用途,注意对相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | HF的沸点高于HCl | B. | 金刚石的熔点比晶体硅高 | ||
| C. | 稀有气体一般很难发生化学反应 | D. | 常温下单质溴呈液态、碘呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 发生的现象 | 解释或结论 |
| A | 向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的亚硫酸钡是难溶解于水的沉淀 |
| B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入硝酸中 | 产生白色沉淀 | 常温下铜和硝酸一定产生NO2 |
| D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3=N2+3H2-46.19kJ | B. | 2NH3(g)=N2(g)+3H2(g)-46.19kJ | ||
| C. | NH3(g)=$\frac{1}{2}{N_2}$(g)+$\frac{3}{2}{H_2}$(g)-46.19kJ | D. | 2NH3(g)=N2(g)+3H2(g)+92.38kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
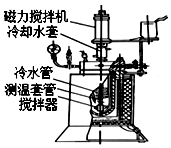 实验室用间二硝基苯通过催化加氢制备间硝基苯胺的实验步骤如下:
实验室用间二硝基苯通过催化加氢制备间硝基苯胺的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若选用酚酞作指示剂,终点时,液体恰好褪色 | |
| B. | 用量筒量取上述盐酸 | |
| C. | 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大 | |
| D. | 盐酸的浓度为1.00 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 | |
| B. | 大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| C. | 大量燃烧化石燃料排放的废气中含有大量SO2,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com