
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于100/ρmL |
分析 溶液在稀释前后溶质的质量不变,硫酸的浓度越大,密度越大,质量分数w越大,据此结合c=$\frac{1000ρω}{M}$列式计算即可,注意水的密度与硫酸的密度小.
解答 解:稀释前后溶质的质量不变,设加水的质量为x,稀释前的质量分数为w1,稀释后的质量分数为w2,
则:100g×w1=(100g+x)×w2,
18mol•L-1的浓硫酸加到一定量的水中稀释成9mol•L-1的硫酸,
由c=$\frac{1000ρω}{M}$可得:c1=$\frac{1000{ρ}_{1}{w}_{1}}{M}$=18mol/L=2c2=$\frac{1000{ρ}_{2}{w}_{2}}{M}$×2,
硫酸的浓度越大,密度越大,则ρ1>ρ2,$\frac{{w}_{1}}{{w}_{2}}$=2×$\frac{{ρ}_{2}}{{ρ}_{1}}$<2,
所以:$\frac{100+x}{100}$=$\frac{{w}_{1}}{{w}_{2}}$<2,
解得:x<100g,
又水的密度约为1g/mL,
则加水的体积小于100mL,
故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度及表达式,明确物质的量浓度与溶质质量分数的关系为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减少 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气在光照下反应只生成一氯乙烷 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | |
| B. | 该反应只有K2FeO4为氧化产物 | |
| C. | 3mol氯气参与反应转移电子数为6个 | |
| D. | 该反应条件下K2FeO4的氧化性大于Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
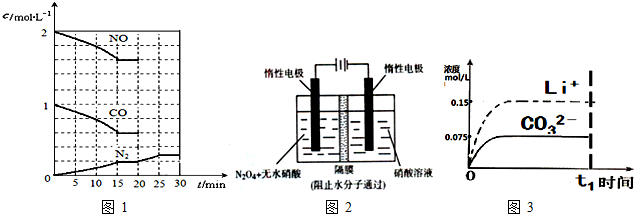 (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②③ | C. | ②③④⑥ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com