

| A.原子半径:Z>Y>X |
| B.气态氢化物的还原性:W>R |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.含Z的盐溶液一定显示酸性 |
科目:高中化学 来源:不详 题型:填空题

| 实验步骤 | 实验现象 | 实验依据和结论 |
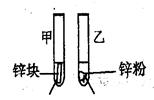 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第三周期金属元素的氧化物都属于碱性氧化物 |
| B.电子层结构相同的不同离子,其半径随核电荷数增大而减小 |
| C.IA族元素的金属性一定比IIA族元素的金属性强 |
| D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | R | |
| X | T | Z |
| | Q | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
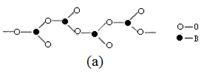
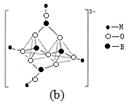
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.47 | B.57 | C.61 | D.175 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| | | | |||||||||||||||
| | | | | | a | | b | | |||||||||
| | | c | | | d | e | | ||||||||||
| | | | | | | | | f | | g | | | | | | | |
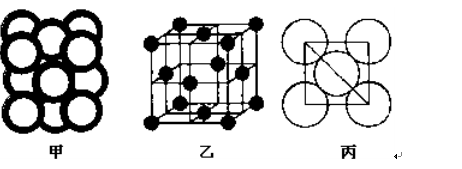
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com