
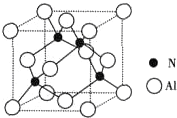
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| ||
| 晶体边长3 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
| ② | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
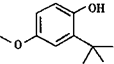
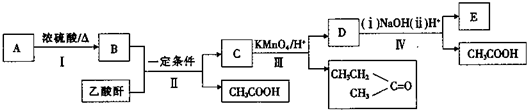
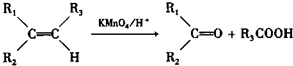
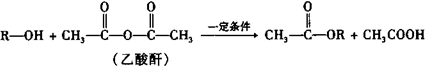
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、NaOH和Na2CO3 |
| C、Na2O2和Na2CO3 |
| D、Na2O2、NaOH和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
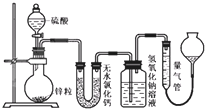 不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com