
| A. | 少量铁粉加入AgNO3溶液中 | |
| B. | 少量Na2O2粉末加入CuSO4溶液中 | |
| C. | 少量BaSO4粉末加入饱和Na2CO3溶液中 | |
| D. | 少量Al2(SO4)3粉末加入Ba(OH)2溶液中 |
分析 A、少量铁粉加入AgNO3溶液中发生反应为Fe+2AgNO3=2Ag+Fe(NO3)2;
B、少量Na2O2粉末加入CuSO4溶液中发生反应为2Na2O2+2H2O+2CuSO4=2Na2SO4+O2↑+2Cu(OH)2↓;
C、少量BaSO4粉末加入饱和Na2CO3溶液中,方程式为:BaSO4+Na2CO3=Na2SO4+BaCO3;
D、少量Al2(SO4)3粉末加入Ba(OH)2溶液中反应为:Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓.
解答 解:A、少量铁粉加入AgNO3溶液中发生反应为Fe+2AgNO3=2Ag+Fe(NO3)2,设进入溶液的铁是56g,从溶液中出来的是银是216g,所以进入溶液的质量小,出来的多,故溶液质量减少,故A错误;
B、少量Na2O2粉末加入CuSO4溶液中发生反应为2Na2O2+2H2O+2CuSO4=2Na2SO4+O2↑+2Cu(OH)2↓,设进入溶液的是Na2O2是156g,从溶液中出来的是氧气和氢氧化铜共32g+196g=228g,所以进入溶液的质量小,出来的大,故溶液质量减少,故B错误;
C、少量BaSO4粉末加入饱和Na2CO3溶液中,方程式为:BaSO4+Na2CO3=Na2SO4+BaCO3,设进入溶液的是BaSO4是233g,从溶液中出来的是碳酸钡197g,所以进入溶液的质量大,出来的小,故溶液质量增加,故C正确;
D、少量Al2(SO4)3粉末加入Ba(OH)2溶液中发生的反应为:Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓,进入溶液的铝离子与氢氧根结合成沉淀,硫酸根与钡离子结合成沉淀出来了,所以出来的多,则溶液质量减少,故D错误.
故选:C.
点评 本题考查溶液质量的变化,关键是看反应前后溶液溶质的变化,明确溶液中的物质和从溶液中进出物质的质量差为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.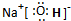 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-8 | 4.9×10-10 | K1;4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
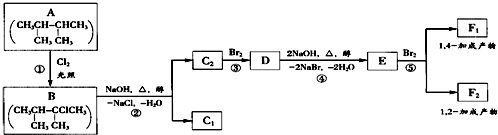
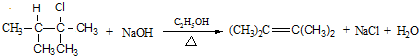 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12有2种同分异构体 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得物质共有6种 | |
| C. | C8H10中只有三种属于芳香烃的同分异构体 | |
| D. | CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com