
 CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
 CH3OCH3(g)+H2O(g)可知起始时CH3OH的浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,故A错误;
CH3OCH3(g)+H2O(g)可知起始时CH3OH的浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,故A错误; CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)

科目:高中化学 来源:不详 题型:填空题
| | 活性炭 (mol) | NO (mol) | A (mol) | B (mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g)ΔH=-1025 kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g)ΔH=-1025 kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
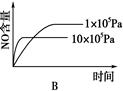
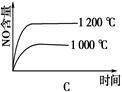
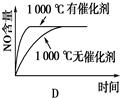
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?2X Y2(g) ΔH<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是
?2X Y2(g) ΔH<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是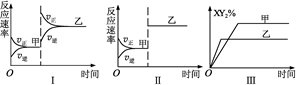
| A.图Ⅰ由甲至乙加入适当催化剂 | B.图Ⅱ由甲至乙扩大容器体积 |
| C.图Ⅲ由甲至乙增大压强 | D.图Ⅲ由甲至乙升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )| A.在液氨中加入NaNH2,可使液氨的离子积变大 |
| B.在液氨中加入NH4Cl,液氨的离子积不变 |
| C.此温度下液氨的离子积K为1×10-30 |
| D.在液氨中加入金属钠可能有NaNH2生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
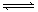 XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:| A.①③④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应:2CO(g)+2NO(g) |
| B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| C.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 |
D.反应:2A(g)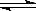 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com