
| A、升高温度能够增大0.1mol?L-1的HF的电离程度 |
| B、合成NH3反应中,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| C、对平衡体系:CO(g)+NO2(g)?CO2(g)+NO(g)加压,可使颜色变深 |
| D、溴水中存在平衡:Br2+H2O?HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
| A、16g O3与 O2混合物中所含氧原子数为NA |
| B、2.3gNa+中含有的电子数为0.1NA |
| C、在常温常压下11.2L二氧化碳所含的分子数目为0.5NA |
| D、相同质量的两块钠分别变成氧化钠和过氧化钠前者失去的电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与盐酸反应:Fe+2H+=Fe3++H2↑ |
| B、氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、氯化铝中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、向水玻璃中加盐酸:SiO32-+2H+=H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、164 kg |
| B、2.5 mol |
| C、2 500 mol |
| D、2 500 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
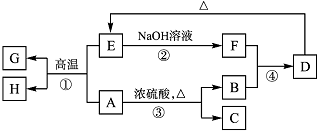 已知A、B、C、D、E、F、G、H可以发生如下图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.
已知A、B、C、D、E、F、G、H可以发生如下图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mol?l -1 |
| B、4.5 mol?l -1 |
| C、7.0 mol?l -1 |
| D、9.0 mol?l -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤ | B、④⑤ |
| C、①③⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
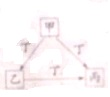
| A、若丁为KOH溶液,则甲可能为Al |
| B、若丁为Fe,则丙可能为Fe(NO3)2溶液 |
| C、若丁为O2,则甲可为非金属单质硫 |
| D、若甲、乙、丙均为焰色反应呈黄色的化合物,则丁一定为CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com