
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
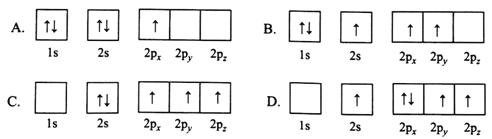
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
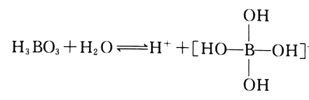
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
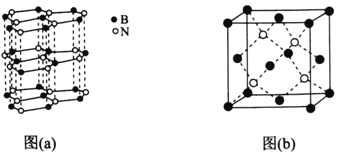
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
【答案】A D 3.612×1024(或6.NA) 平面三角形 sp2 BF3中B原子有空轨道,O(C2H5)2中氧原子上有孤对电子,能形成配位键 7 六方BN晶体中层与层之间的作用力是较弱 的范德华力,故层与层之间相对易滑动 六方BN的结构中没有像石墨中有自由移动的电子, ![]() 或
或![]()
【解析】
根据价层电子对互斥理论分析分子的空间构型;根据晶胞中微粒的数目计算晶胞的密度。
(1) 能级能量由低到高的顺序为:1s、2s、2p;每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,能量最低,由此分析,A能量最低,D能量最高,
故答案为:A、D;
(2) 硼酸中有B原子与3个羟基通过三对共用电子对结合,另外每个羟基中有1对共用电子对,所以1mol硼酸中共用电子对数为6NA个,
故答案为:6NA;
(3) BF3中B原子价层电子对个数=3+1/2×(3-3×1)=3,B原子价层电子对个数为3且不含孤电子对,所以为平面三角形结构;B的杂化类型为sp2;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是:BF3中B原子有空轨道,O(C2H5)2中氧原子上有孤对电子,能形成配位键,
故答案为:平面三角形,sp2,BF3中B原子有空轨道,O(C2H5)2中氧原子上有孤对电子,能形成配位键;
(4) 单键是σ键,双键中含有1个σ键,从上述结构简式中可以看出还有3个C-H键,所以一共有7个σ键,
答案为:7;
(5) 由图示结构可以看出①六方BN具有良好的润滑性,是因为:六方BN晶体中层与层之间的作用力是较弱 的范德华力,故层与层之间相对易滑动;六方BN不能像石墨一样具有导电性,其原因是六方BN的结构中没有像石墨中有自由移动的电子;
②已知立方BN的晶胞参数为0.3615nm,则晶胞体积为:(0.3615![]() 10-7 )3cm3,晶胞中B原子数目为:8
10-7 )3cm3,晶胞中B原子数目为:8![]() 1/8+6
1/8+6![]() 1/2=4原子,N原子数目为:4,则立方BN的密度为:
1/2=4原子,N原子数目为:4,则立方BN的密度为:![]() ,
,
故答案为:![]() 。
。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是
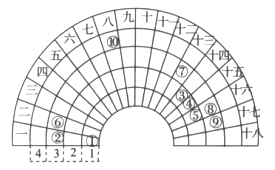
A. ②、⑧、⑨对应简单离子半径依次减小
B. 该表中标注的元素全部是主族元素
C. 元素⑥和⑦的原子序数相差11
D. ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LCHCl3 中含有氯原子数目为 3NA
B. 18g D2O 和 18g H2O 中含有的质子数均为 10NA
C. 4.6gNa 与 O2反应生成 Na2O 和 Na2O2 混合物时失去的电子数为 0.2NA
D. 25℃时 pH=13 的 Ca(OH)2溶液中含有 OH-的数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应S(s)+O2(g)![]() SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
(1)升温_____;
(2)增大压强_____;
(3)增大容器容积____;
(4)加入O2____;
(5)加入S_____;
(6)加正催化剂_____。
(7)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______。
A.消耗1molO2同时生成1molSO2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.v正(O2)=v逆(SO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖3.42 g与淀粉3.24 g混合并完全水解,若生成mg葡萄糖和ng果糖,则m:n为
A. 1:3 B. 1:5 C. 5:1 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1molCH4和4molCl2反应生成的有机物分子总数为4NA
B. 0.1molH35Cl中含有的质子数目或中子数目均为1.8NA
C. 常温下,22.4L乙烯中含有的共用电子对数目为6NA
D. 1molN2与足量H2发生合成氨反应时转移的电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. S(s)+3/2O2(g)=SO3(g) △H=-315kJ·mol-1(燃烧热)(△H的数值正确)
B. 氢气的燃烧热为285.5kJmol-1,则2H2O(l)=2H2(g)+O2(g) △H=+285.5kJmol-1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1;将3 mol H2和过量的N2在此条件下充分反应,放出的热量小于92.4kJ
2NH3(g) △H=-92.4kJmol-1;将3 mol H2和过量的N2在此条件下充分反应,放出的热量小于92.4kJ
D. 已知HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq) △H=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:
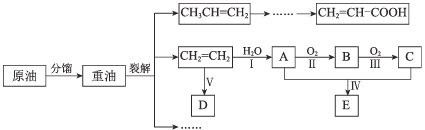
已知:2CH3CHO + O22CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是_________________ 。
(2)E有香味,实验室用A和C反应来制取E
①反应IV的化学方程式是_______________________________________ 。
②实验结束之后,振荡收集有E的试管,有无色气泡产生其主要原因是(用化学方程式表示)______
(3)产物CH2=CH-COOH可能发生的反应有____________(填序号)。
a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应
(4)①A是乙醇,与A相对分子质量相等且元素种类相同的有机物的结构简式是:_____、_____。
②为了研究乙醇的化学性质,利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(加热、固定和夹持装置已略去)
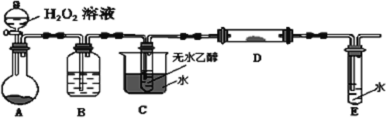
1)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。
2)实验时D处装有铜粉,点燃D处的酒精灯后,D中发生的主要反应的化学方程式为__________,当反应进行一段时间后,移去酒精灯,D中仍然继续反应,说明D处发生的反应是一个________反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列民俗、诗句、谚语等包含吸热反应的是( )
A.民间焰火之最——确山打铁花B.千锤万凿出深山,烈火焚烧若等闲
C.只要功夫深,铁杵磨成针D.冰,水为之,而寒于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com