
下列关于离子共存或离子反应的说法正确的是( )
A.某无色溶液中可能大量存在H+、Cl-、MnO4-、[Al(OH)4]-
B.pH=3的溶液中可能大 量存在Na+、NH4+、Fe3+、SiO32-
量存在Na+、NH4+、Fe3+、SiO32-
C.水中通入氯气:C12+H2O=C1O-+Cl-+2H+
D.稀硫酸和氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2016-2017学年四川省高一11月月考化学卷(解析版) 题型:选择题
为除去括号内的杂质,所选用的试剂或方法正确的是
A. Na2CO3溶液(NaHCO3),加适量的Ca(OH)2溶液,过滤
B.Mg (Al),加过量的NaOH溶液,过滤
C.FeCl3溶液(CuCl2),加入过量的Fe粉,过滤
D.NaHCO3溶液(Na2CO3),加适量的CaCl2溶液,过滤
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
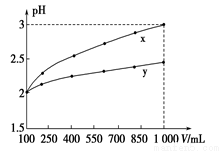
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:推断题
下图表示几种无机物之间的转换关系。其中A为磁性黑色晶体,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体。
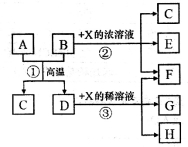
请回答下列问题:
(1)A的化学式为____________,C的电子式为_______________。
(2)反应②的化学方程式为___________________________。
(3)A与盐酸反应的离子方程式为________________________。
(4)反应③在X溶液温度、浓度不同时,产物也不同,则过量的D分别与一定量不同温度、浓度的X稀溶液反应时,若4mol X参加反应转移了3mol电子,此时反应的离子方程式为____________________;若5mol X参加反应转移了4mol电子,此时X的还原产物可能是下列选项中的______________。
a.NO b.N2O c.N2 d.NH4NO3
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:选择题
向50mL14.0 mol·L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为( )
A.6.4g B.12.8g C.19.2g D.38.4g
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:推断题
【化学一选修3:物质结构与性质】A、B、C、D、E五种元素的原子序数依次增大。A 是原子半径最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态E原子核外电子的排布式为___________________。
(2)B、C、D三种元素的电负性由大到小的顺序是____________(填元素符号)。A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为_____________,阴离子的中心原子轨道采用______________杂化。
(3)E(CA3)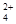 离子的颜色是___________;含有化学键类型是_____________;离子中C原子杂化轨道类型是__________________。
离子的颜色是___________;含有化学键类型是_____________;离子中C原子杂化轨道类型是__________________。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为______________________。
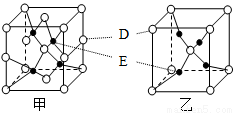
(5)若甲的密度为ρ g/cm3,NA表示阿伏加德罗常数,则甲晶胞的边长可表示为_________cm。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
C.铅蓄电池充电时阳极反应:PbSO4+2e-=Pb+SO42-
D.Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:填空题
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)=CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:

由此计算△H1=kJ.mol-1,
已知:△H2=-58kJ.mol-1,则△H3=kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为____________(填曲线标记字母),其判断理由是____________。
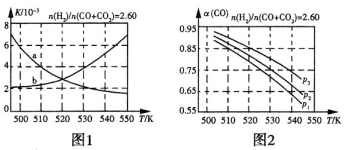
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而_____________(填“增大”或“减小”),其原因是_____________。图2中的压强由大到小为___________,其判断理由是____________。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
以NA表示阿伏伽德罗常数的值,下列说法中正确的是
A.含4molHCl的浓盐酸与足量的MnO2反应,生成的Cl2分子数目为NA;
B.标准状况下,80gSO3所含的原子数为4NA
C.46gNa与一定量O2完全反应生成Na2O和Na2O2,转移电子数为3NA
D.常温下,46gNO2和N2O4的混合体系中含有的氮氧原子数2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com