
氯气在工业上有着重要的用途,某兴趣小组在实验室中用下列装置模拟工业上用氯气制备无水氯化铝(183℃时升华,遇潮湿空气即产生大量白雾)。
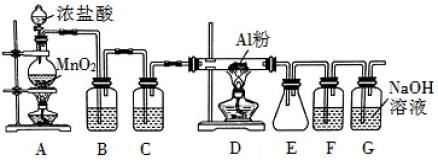
 请回答下列问题:
请回答下列问题:
(1)装置 B 中盛放饱和食盐水,其作用是 。F 中盛放的是 ,其作用是 。用一件仪器装填适当试剂后也可起到 F 和 G 的作用,所装填的试剂为 。
(2)装置 A 实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入 MnO2 粉末 B.加热 C.往烧瓶中加入浓盐酸
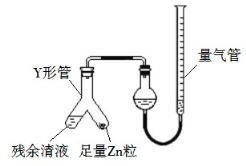
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学 提出很多实验方案,其中方案之一为让残留的液体与足量 Zn 反应,测量生成的 H2体积。 装置如图所示(夹持器具已略去)。反应完毕,每间隔 1 分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 ClO2 生成;ClO2 沸点为 10 ℃,熔点为?59 ℃,液体为红色;Cl2 沸点为?34 ℃,液态为黄绿色。设计最简单的实验验证 Cl2中含有 ClO2: 。
科目:高中化学 来源:2017届北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
2SO2(g) + O2(g) 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
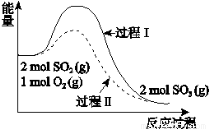
A.a<0
B.过程II可能使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.反应物断键吸收能量之和小于生成物成键释放能量之和
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:实验题
有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验:
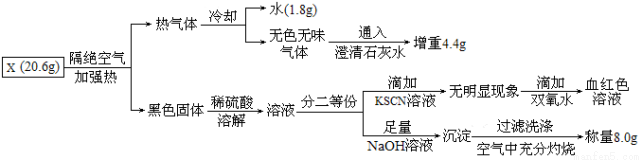
请回答:
(1)X的化学式_________ ________,挖出后在空气中容易发黄的原因______________。
________,挖出后在空气中容易发黄的原因______________。
(2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:___________________,_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分液时下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
B.pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿
C.用药匙取用粉末状或小颗粒状固体
D.蒸馏时蒸馏烧瓶中的液体尽量多些,加沸石进行蒸馏,但液体也不能蒸干
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
在某 100mL 混合酸中,HNO3 物质的量浓度为 0.4mol/L,H2SO4 物质的量浓度为0.2mol/L。向其中加入 1.92g 铜粉微热,待充分反应后,溶液中 Cu2+物质的量浓度约为
A 0.15mol/L B 0.3mol/L C 0.225mol/L D 无法计算
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
某化学兴趣小组进行有关 Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为 NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4==4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu 在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( )
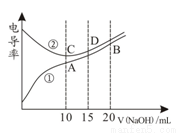
A.曲线①代表滴定CH3COOH溶液的曲线
B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C
C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:推断题
A、B、D、E、Z、G、M七种元素位于元素周期表前四周期,原子序数依次增大。元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物DE2为红棕色气体,Z的单质易与水反应且只作氧化剂,G是前四周期中第一电离能最小的元素,M是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题:
(1)元素B、D、E的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)基态G原子的价电子排布式是 ,M在元素周期表中的位置是 。
(3)元素D和Z组成分子NZ3空间构型为________;该分子为 分子(填极性或非极性),其中D原子的杂化方式为________。
(4)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙常温下,若甲、乙两溶液的pH均等于5,则由水电离出的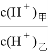 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为____________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是 ;
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com