
(1)若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_________________。
(2)分子式为C9H20的某烃其一氯代物只有两种产物,写出符合要求的结构简式________________。
(3)分子式为C5H10的烯烃中不存在顺反异构的物质有_____种。
(4)已知烯烃、炔烃在臭氧作用下发生以下反应:
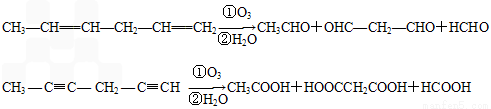
某烃化学式为C10H10,在臭氧作用下发生反应:C10H10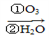 CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
②C10H10结构简式为________________。
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源:2016-2017学年湖南省长沙市高二上学期期末考试化学试卷(解析版) 题型:选择题
从溴乙烷制取1,2-二溴乙烷,下列制备方案中最好的是
A. 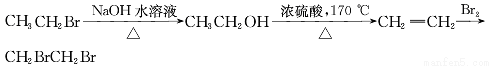
B. 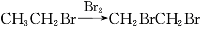
C. 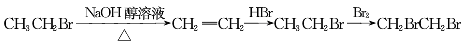
D. 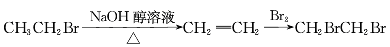
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
0.3L 1mol·L-1FeCl3溶液与0.2L 1mol·L-1KCl溶液中,Cl-浓度比是
A. 9:2 B. 3:2 C. 3:1 D. 1:1
查看答案和解析>>
科目:高中化学 来源:2017届陕西省榆林市高考模拟第一次测试理综化学试卷(解析版) 题型:简答题
钴周期表第四周期第Ⅷ族元素,其化合物用途广泛,如:LiCoO2做锂电池的正极材料;草酸钴可用于指示剂和催化剂制备。
Ⅰ.(1)LiCoO2中钴元素的化合价为_______
(2)工业上将废锂电池的正极材料与过氧化氢溶液,稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为:______________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是____________
Ⅱ.利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(3)浸出液中加NaClO3的目的是:______________.
(4)请用平衡移动原理说明加Na2CO3调pH至5.2所得沉淀的原因:____________
(5)滤液Ⅱ中加入萃取剂的作用是___________
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省榆林市高考模拟第一次测试理综化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A. 100mL12mol/L浓盐酸与足量MnO2共热,转移的电子数为0.6NA
B. 1mol/L的NaClO溶液中含有ClO-的数目为小于NA
C. 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA
D. O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得溶液中加入0.2mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为
A. 1.0mol B. 1.2mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 HBr溶液和20.00 mL0.1000 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,下列说法不正确的是( )
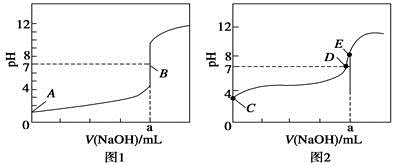
A. 根据图1和图2判断,滴定HBr溶液的曲线是图1
B. a=20.00 mL
C. c(Na+)=c(CH3COO-)的点是B点
D. E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
下列溶液中c(Cl-)与50 mL 1 mol/L AlCl3溶液中c(Cl-)相等的是( )
A. 150 mL 1 mol/L的NaCl溶液 B. 75 mL 2 mol/L的NH4Cl溶液 C. 150 mL 2 mol/L的KCl溶液 D. 75 mL 1 mol/L的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:填空题
甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g) CH3OH(g) △H。
CH3OH(g) △H。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间的变化如下图甲所示。
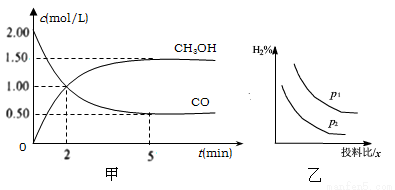
①从反应开始到5min,用氢气表示的平均反应速率v(H2)=________。
②下列说法正确的是________(填序号)。
A. 达到平衡时,H2的转化率为75%
B. 5min后容器中压强不再改变
C. 达到平衡后,再充入氩气,反应速率增大
D. 2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.35molCO气体,则此平衡将___(填“正向移动”“不移动”或“逆向移动”)
(3)若压强、投料比x [n(CO)/n(H2)]对反应的影响如图乙所示,则图中曲线所示的压强关系:p1___p2(填“=”“>”或“<”),其判断理由是__________。
(4)甲醇是一种新型的汽车动力燃料。已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____。
(5)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如下图所示。b中甲醇体积分数大于a中的原因是_____。达到平衡时,a、b、c中CO的转化率大小关系为___________。
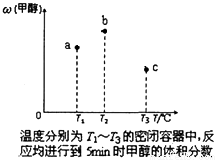
(6)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com