
【题目】在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:

(1)写出醋酸的电离方程式___________________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是_________。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:c(H+)甲_____ 10c(H+)乙(填“大于”、“小于”或 “等于”)
(5)醋酸与氨水反应的离子方程式:__________________ 。
【答案】CH3COOH![]() CH3COO-+H+ c<a<b c 小于 CH3COOH+NH3H2O═CH3COO-+NH4++H2O
CH3COO-+H+ c<a<b c 小于 CH3COOH+NH3H2O═CH3COO-+NH4++H2O
【解析】
(1)醋酸为弱电解质,存在电离平衡;
(2)溶液导电能力越大,溶液中c(H+)浓度越大;
(3)醋酸是弱酸,醋酸电离程度与其浓度成反比;
(4)醋酸是弱电解质,稀释过程中促进醋酸电离;
(5)酸碱中和生成盐和水,注意弱电解质不可写成离子形式。
(1)醋酸为弱电解质,存在电离平衡,电离方程式为CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
答案:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
(2)溶液导电能力与离子浓度成正比,所以导电能力越大,溶液中c(H+)浓度越大,根据图象知,a、b、c、三点溶液c(H+)的大小顺序是c<a<b;
答案:c<a<b
(3)醋酸是弱酸,醋酸电离程度与其浓度成反比,所以溶液越稀其电离程度越大,根据图象知,溶液浓度最小的是c,所以a、b、c三点醋酸的电离程度最大c;
答案:c;
(4)醋酸是弱电解质,稀释过程中促进醋酸电离,溶液越稀,醋酸的电离程度越大,所以c(H+)甲<10c(H+)乙;
答案:小于
(5)酸碱中和生成盐和水,注意弱电解质不可写成离子形式,离子方程式为: CH3COOH+NH3H2O═CH3COO-+NH4++H2O;
答案:CH3COOH+NH3H2O═CH3COO-+NH4++H2O


科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
C. 实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D. 石灰岩受地下水长期溶蚀形成溶洞
石灰岩受地下水长期溶蚀形成溶洞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____;Ti原子核外共有________种运动状态不同的电子。
(2)BH3分子与NH3分子的空间结构分别为_________;BH3与NH3反应生成的BH3·NH3分子中含有的化学键类型有_______,在BH3·NH3中B原子的杂化方式为________。
(3)N和P同主族。科学家目前合成了N4分子,该分子中N—N—N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途___________。(写出一种即可)
(4)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是____。
(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲,主要原因是______。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
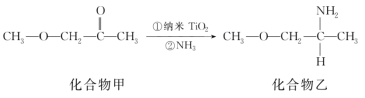
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) △H1=-890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) △H2=-1299.6J/mol
2H2(g)+O2(g)=2H2O(1) △H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的△H=_____kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
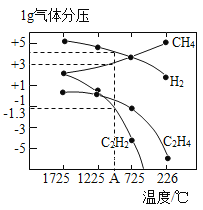
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 常温常压下,4.6 g NO2气体约含有1.806×1023个原子
B. 标准状况下,80 g SO3所占的体积约为22.4 L
C. 标准状况下,22.4 L CCl4中含有的CCl4分子数为NA
D. 标准状况下,22.4 L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式: ________________ 。
(2)用电子排布图表示D元素原子的价电子:__________。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 羟基与氢氧根离子有相同的化学式和电子式
B. 乙醇的官能团是—OH,可与NaOH溶液发生中和反应
C. 常温下,1 mol乙醇可与足量的Na反应生成11.2 L H2
D. 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为①③
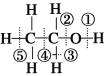
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示。则下列有关说法中不正确的是
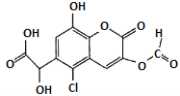
A. 能发生加成、取代、氧化反应B. 能与FeC13溶液发生显色反应
C. 1mol该物质最多可与6molH2反应D. 1mol该物质最多可与7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是

A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com