

| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
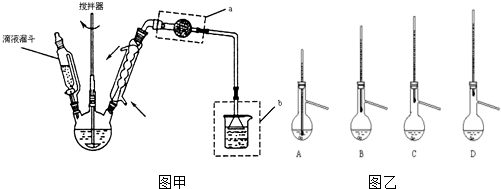
分析 A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;用饱和食盐水除去HCl;
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O;控制反应温度在70℃左右,应采取水浴加热;
(3)CCl3COOH溶于乙醇与CCl3CHO;
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算;
(6)酸性越强,电离程度越大,溶液pH越小.
解答 解:A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;饱和食盐水;
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O,导致装置D中副产物:CCl3COOH、C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:CCl3COOH、C2H5Cl;水浴;
(3)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量0.02000mol•L-1×0.02L×$\frac{1}{2}$=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol•L-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为$\frac{1.8×1{0}^{-3}mol×147.5g/mol}{0.3g}$×100%=88.5%,
故答案为:88.5%;
(6)分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强;
故答案为:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
点评 本题考查有机物制备、物质含量程度、实验方案设计等,关键是明确反应原理与各装置作用,掌握常用物质分离提纯方法,注意对题目信息的应用,难度中等,侧重于考查学生的实验探究能力和计算能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 证明某溶液中存在Fe2+ | 先加少量氯水,再滴加KSCN溶液,出现血红色 |
| B | 测定熔融苛性钠的导电性 | 在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C | 证明氯的非金属性大于碳 | 向碳酸钙中滴加盐酸,有气泡产生 |
| D | 制备氯化镁晶体 | 将MgCl2溶液在氯化氢的气流中蒸干 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
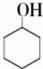 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$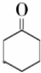
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
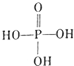
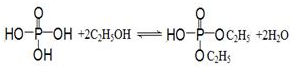 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com