
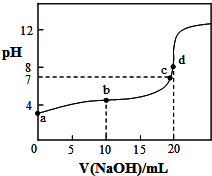
 室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点:由水电离出的c(H+)=1.0×10-3mol/L | |
| B. | b点:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) | |
| C. | c点:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | d点:c(OH-)-c(H+)=c(CH3COOH) |
分析 A.a点为醋酸溶液显酸性,水的电离受到抑制;
B.b点NaOH为10mL,醋酸只反应的一半,溶液的溶质为醋酸和醋酸钠;
C.c点溶液显中性,根据电荷守恒分析;
D.d点醋酸与NaOH恰好反应生成醋酸钠,根据质子守恒分析.
解答 解:A.a点为醋酸溶液显酸性,水的电离受到抑制,则由水电离出的c(H+)<1.0×10-7mol/L,故A错误;
B.b点NaOH为10mL,醋酸只反应的一半,溶液的溶质为醋酸和醋酸钠,而且二者的物质的量相同,溶液显酸性,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B错误;
C.c点溶液显中性,则c(H+)=c(OH-),电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),故C错误;
D.d点醋酸与NaOH恰好反应生成醋酸钠,溶液中质子守恒为c(OH-)=c(H+)+c(CH3COOH),则c(OH-)-c(H+)=c(CH3COOH),故D正确.
故选D.
点评 本题考查了酸碱混合溶液的有关计算,要解题时要分清楚每个状态时溶液的组成情况,并注意各种守恒思想的灵活利用,题目难度中等.


科目:高中化学 来源: 题型:填空题
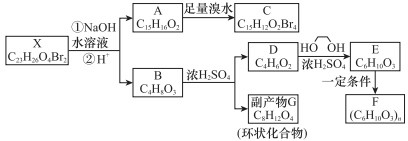
 ,化合物C的1H-NMR谱的峰面积之比为1:2:3(按从小到大的顺序填写)
,化合物C的1H-NMR谱的峰面积之比为1:2:3(按从小到大的顺序填写) .
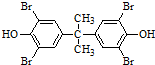
.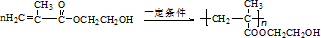 .
.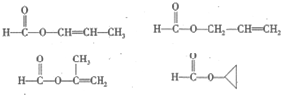 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 溴乙烷、苯酚一定条件下都能与NaOH水溶液发生反应 | |
| C. | 葡萄糖和蔗糖溶液都能发生银镜反应 | |
| D. | 乙酸乙酯和纤维素乙酸酯均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由元素的原子序数推测其在元素周期表中的位置 | |
| B. | 由H-H和Cl-Cl的键长推测液氢和液氯沸点的高低 | |
| C. | 由CaF2晶体中,与Ca2+距离最近的F-有8个,推知与F-距离最近的Ca2+也有8个 | |
| D. | 由N≡N、H-H、N-H的键能数据估算3H2(g)+N2(g)?2NH3(g)的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
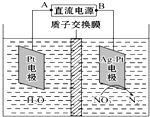
| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | 阴极反应式为2 NO3-+12H++10e-=N2↑+6H20 | |
| D. | 若电解过程中转移了2 mol电子,则左侧电解液的质量减少了16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物的热稳定性:HQ>HY | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
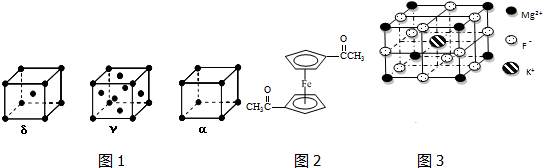
 .已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.
.已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com