
分析 【结论】根据氯气和氯水的颜色可以判断氯水中含有氯气分子;
【实验现象】盐酸显示酸性,能够使蓝色石蕊试纸变红;
【分析与结论】氯水呈黄绿色,说明氯水中溶有氯气分子;
【问题与思考】氯气与水反应生成氯化氢和次氯酸,据此写出反应的化学方程式;
根据Cl2+H2O═HCl+HClO,设计实验证明干燥的氯气、水、盐酸都没有漂白性,而氯水有漂白性,就可推知氯水的漂白性实质为氯气和水反应生成的次氯酸的漂白性,据此进行设计实验方案.
解答 解:【结论】氯气的颜色为黄绿色;氯水的颜色也呈黄绿色,说明氯水中含有氯气分子,
故答案为:氯气;
【实验现象】盐酸能够使蓝色石蕊试纸变红,则滴有盐酸的试纸变红色,
故答案为:红;
【分析与结论】氯水呈黄绿色,说明氯水中溶有氯气分子,
故答案为:氯气;
【问题与思考】氯气与水反应生成氯化氢和次氯酸,反应方程式为:Cl2+H2O═HCl+HClO,
故答案为:Cl2+H2O═HCl+HClO;
根据Cl2+H2O═HCl+HClO,设计实验证明干燥的氯气、水、盐酸都没有漂白性,而氯水有漂白性,就可推知氯水的漂白性实质为氯气和水反应生成的次氯酸的漂白性;收集干燥的氯气用有色纸条设计实验进行检验,湿润的有色纸条遇到干燥氯气会褪色,干燥有色纸条遇到干燥氯气不褪色证明,据此可设计如下实验方案:
【实验操作】收集一集气瓶干燥的氯气,用镊子夹取一片一端湿润的有色纸条,伸入盛有干燥氯气的集气瓶中,
【实验现象】有色纸条湿润的一端褪色,另一端无明显变化
【分析与结论】干燥的有色纸条不褪色,证明氯气本身无漂白作用.又知水和盐酸都没有漂白作用,容易推知:湿润的有色纸条褪色,是因为氯气溶于水发生反应Cl2+H2O═HCl+HClO,溶液中的次氯酸具有漂白性;
故答案为:[操作]将干燥的氯气分别通入装有干燥的红纸、潮湿的红纸的集气瓶;[现象]干燥的红纸不变色,潮湿的红纸褪色;[结论]氯分子不具有漂白作用,次氯酸才能使有色物质褪色.
点评 本题考查了物质性质验证实验的设计,侧重考查氯气、次氯酸性质比较分析判断,题目难度中等,注意掌握氯气的化学性质,明确次氯酸具有漂白性,氯气无漂白性.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.
翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有② | C. | ①②③的混合物 | D. | ①②③④的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
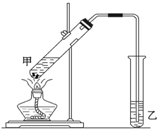 在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答.
在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
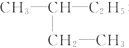 和
和
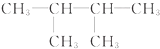 和
和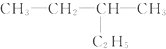
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com