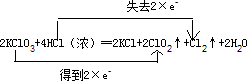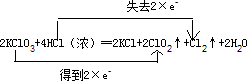KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O.(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.1molCl2,则转移电子的物质的量为______mol.
(4)用双线桥法标出该反应的电子转移的方向和数目______.
【答案】
分析:(1)由反应的化学方程式中元素的化合价变化及生成物来分析浓盐酸的性质;
(2)由反应中转移的电子数与生成氯气的关系来计算生成0.1molCl
2转移电子的物质的量;
(3)KClO
3中Cl元素的化合价由+5价降低为+4价,HCl中Cl元素的化合价由-1价升高到0,标电子转移的方向和数目.
解答:解:(1)在反应2KClO
3+4HCl(浓)═2KCl+2ClO
2↑+Cl
2↑+2H
2O中,HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又该反应生成盐KCl,则表现酸的酸性,
故答案为:②;
(2)由反应可知,氯酸钾中Cl元素的化合价由+5降低为+4,则2molKClO
3反应转移的电子数为2mol×(5-4)=2mol,
即生成1molCl
2转移电子的物质的量2mol,则产生0.1molCl
2转移电子的物质的量0.2mol,故答案为:0.2;
(3)该反应中KClO
3中氯元素化合价由+5得一个电子变成+4价,HCl中氯元素由-1价失一个电子变成0价,转移电子数是2,可表示为

,
故答案为:

.
点评:本题以氯气的制法来考查酸的性质,氧化还原反应中转移的电子数的计算,明确化合价的变化是分析的关键.

 ,
, .
.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案