
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
分析 B元素原子最外层电子数是内层电子数的2倍,B应为C元素,A原子比B原子多一个电子层,应为第三周期元素,且最外层电子数为6,应为S元素,C原子比B原子少一个电子层,应为第一周期元素,结合最外层电子数解答.
解答 解:B元素原子最外层电子数是内层电子数的2倍,B应为C元素,A原子比B原子多一个电子层,应为第三周期元素,且最外层电子数为6,应为S元素,C原子比B原子少一个电子层,应为第一周期元素,且最外层电子数为2,应为He,
故选D.
点评 本题涉及原子结构与元素周期率的考查,侧重于学生的分析能力的培养和原子结构、元素周期率的综合应用的考查,注意把握提给信息以及原子核外电子排布规律,难度不大.


科目:高中化学 来源: 题型:选择题
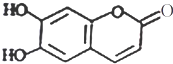
| A. | M的摩尔质量是178 | |
| B. | 1 mol M最多能与2mol Br2发生反应 | |
| C. | 1mol M与足量NaHCO3反应能生成2 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的中子数是175 | B. | 它是第七周期元素 | ||
| C. | 它是活泼的金属元素 | D. | 它的最外层电子数是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| B. | 大部分金属的冶炼都是通过在高温下发生的氧化还原反应实现的 | |
| C. | 臭氧和氧气成键方式相同,打雷闪电时,会有少量氧气转化为臭氧 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
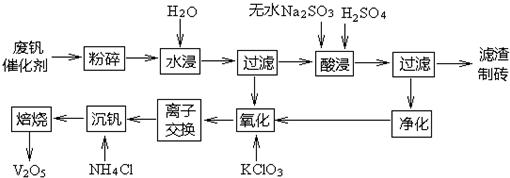
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com