
| A. | 同主族元素的原子半径越大,熔点越高 | |
| B. | 在元素周期表中,s区,d区和ds区的元素都是金属 | |
| C. | 石墨晶体中的作用力有共价键、金属键两种,是一种混合晶体 | |
| D. | 在晶体中只要有阴离子就一定有阳离子 |
分析 A.同主族元素的单质从上到下,非金属性减弱,金属熔点降低,非金属熔点升高;
B、d区和ds区的元素包括副族和第VIII族元素;
C、石墨晶体层与层之间是分子间作用力;
D.晶体中只要有阴离子,必定是离子晶体,所以一定有阳离子.
解答 解:A.卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,故A错误;
B、d区和ds区的元素包括副族和第VIII族元素,副族和第VIII族元素全部是金属元素,而s区中的氢是非金属元素,故B错误;
C、石墨晶体层与层之间是分子间作用力,所以石墨晶体中的作用力有共价键、分子间作用力,无金属键,故C错误;
D.根据离子晶体的概念可知,晶体中只要有阴离子,必定是离子晶体,所以一定有阳离子,故D正确;
故选D.
点评 本题考查了晶体类型、熔沸点的比较,熟悉常见物质中的化学键并能举例即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | (CH3)2BrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明陶瓷材料硒化锌 | B. | 半导体材料砷化镓 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的同分异构体有3种 | |
| B. | 分子式为C5H12O,且能与金属钠反应的同分异构体有8种 | |
| C. | 分子式为C4H8O2属于羧酸类的同分异构体有2种 | |
| D. | 分子式为C4H8O2属于酯类的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
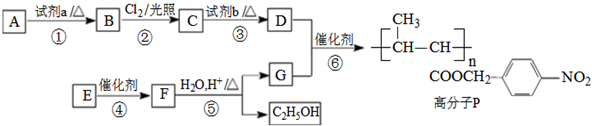
 .
.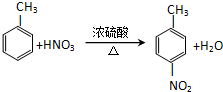 .
.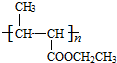 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$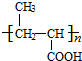 +n CH3CH2OH.
+n CH3CH2OH.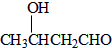 以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaF | B. | CaO | C. | K2S | D. | MgS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+中的“2”表示一个亚铁离子带两个单位正电荷 | |
| B. | 2CO中的“2”表示两个一氧化碳分子 | |
| C. | MgCO3-2中的“2”表示碳酸根的化合价为-2价 | |
| D. | 2O中的“2”表示两个氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com