

分析 (1)金属的利用与金属的活动性和金属的冶炼难易有关;
(2)根据炼铁的原理写出反应的化学方程式;
(3)铁在有水和氧气并存时易生锈;
(4)铝在空气中表面易被氧化生成致密的氧化铝薄膜,据此分析回答;
(5)根据化学式的意义进行有关的计算.
解答 解:(1)金属大规模地开发利用的先后的顺序与金属的活动性和金属冶炼的难易程度有关,金属越活泼越不容易冶炼用的越晚,
故答案为:①③;
(2)一氧化碳在高温条件下把铁从赤铁矿里还原出来,反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2,
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2;
(3)铁在与氧气和水共同存在时容易生锈,铁和杂质碳在电解质溶液中形成原电池反应,发生吸氧腐蚀,
故答案为:水;空气中的氧气;
(4)铝在空气中表面易被氧化成致密的氧化膜,表现出很好的抗腐蚀性,所以填铝表面有致密的氧化铝保护膜,
故答案为:铝的表面生成致密的氧化铝薄膜(或氧化膜),隔绝了铝与空气的接触;
(5)①明矾的相对分子质量为:39+27+(32+16×4)×3+12×18=474,故答案为:474;
②明矾中钾元素、铝元素、硫元素、氧元素、氢元素的质量比为:39:27:(32×2):(16×20):(1×24)=39:27:64:320:24,
故答案为:39:27:64:320:24;
③已知明矾中铝元素的质量分数为5.7%,4克明矾中铝元素的质量为:4g×5.7%=0.228g.
故答为:0.228g.
点评 解答本题关键是要知道金属越活泼越不容易冶炼用的越晚,知道铁生锈的条件,铝易被氧化,理解化学式的意义会进行有关的计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
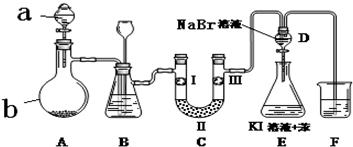
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO在高温条件下还原CuO的反应 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+182.6 kJ•mol-1 | |
| C. | 形成化学键过程中放出862kJ热量的化学反应 | |
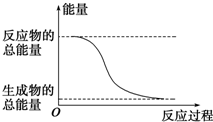
| D. | 能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述钛原子中,中子数不可能为22 | |
| B. | 钛元素位于元素周期表的d区,属过渡元素 | |
| C. | 钛原子的外围电子层排布为3d24s2 | |
| D. | 钛元素在周期表中处于第四周期ⅥB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢中既含有极性键又含有非极性键 | |
| B. | 18O原子中含有18个中子 | |
| C. | 含有相同电子数的H2O和NH3的分子数相同 | |
| D. | 苯分子中所有原子共处在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、AlO2-、CO32- | B. | Ag+、Cu2+、NO3-、Cl- | ||
| C. | Mg2+、Fe3+、Cl-、SO42- | D. | NH4+、K+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、OH-、Cl- | B. | Ba2+、H+、SO42-、CO32- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com