
| A、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热 |
| B、除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法 |
| C、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| D、用四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗上口倒出 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、氢氧化铁胶体稳定存在的主要原因是氢氧化铁胶体带正电荷 |
| B、向BaCl2溶液中通入SO2气体会产生白色沉淀 |
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| D、CuSO4?5H2O是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠水解:HCO3-+H2O?H3O++CO32- |
| B、醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3?H2O |
| C、硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将Al粉投入到NaHSO4溶液中,有气泡生成 |
| B、配制FeCl3溶液时适当加入少量盐酸 |
| C、明矾可作净水剂 |
| D、泡沫灭火器用Al2(SO4)3与NaHCO3为原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A、上述反应是放热反应 |
| B、a=b |
| C、a>b |
| D、上述反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液中先有白色沉淀生成后沉淀全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离的c(H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、CH3COO- | ||
| C、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
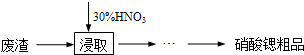
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 | 100 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 | 50.7 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 | 408 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com