
| A. | NaBH4的电子式为 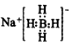 | |
| B. | 该反应在无水环境中进行 | |
| C. | NaBH4是很好的还原剂,常用于有机合成 | |
| D. | 1 molNaBH4与水充分反应可生成标况下44.8LH2 |
分析 A.根据NaBH4为离子化合物书写;
B.根据NaH及易与水反应生成氢氧化钠和氢气判断;
C.NaBH4中H元素的化合价为-1价易升高,所以NaBH4是很好的还原剂;
D.根据NaBH4中H元素的化合价为-1价与水充分反应氢气化合价变化为1计算.
解答 解:A.NaBH4为离子化合物,电子式为 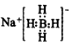 ,故A正确;
,故A正确;
B.反应物NaH及易与水反应生成氢氧化钠和氢气,所以在无水环境中进行,故B正确;
C.NaBH4中H元素的化合价为-1价易升高,所以NaBH4是很好的还原剂,常用于有机合成,故C正确;
D.NaBH4中H元素的化合价为-1价与水充分反应氢气化合价变化为1,则1molNaBH4与水充分反应可生成标况下1mol×4×22.4L/mol=89.6L,故D错误;
故选D.
点评 本题考查电子式的书写、NaH和NaBH4中性质等,注意NaH、NaBH4中H元素的化合价是-1价,会根据化合价的变化计算,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 (1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).
(1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
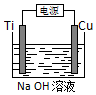
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
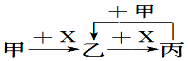 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )| A. | C和O2 | B. | CO2和NaOH溶液 | ||
| C. | Cl2和Fe | D. | AlCl3溶液和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量排放含氮、磷的生活污水可使水体富营养化 | |
| B. | “曾青得铁,则化为铜”是描述金属间的置换反应 | |
| C. | 光化学姻雾的形成主要与硫氧化物的排放有关 | |
| D. | 硅是光伏太阳能电池的光电半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验事制氢气时,加入少量NaNO3固体,不影响反应速率 | |
| B. | 锌片分别与等pH的醋酸、硫酸反应,平均反应速率相等 | |
| C. | 升高温度后,吸热反应的速率加快,放热反应的速率减慢 | |
| D. | 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CH3Cl中所含质子数为26NA | |
| B. | 将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA | |
| C. | 常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA | |
| D. | 0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 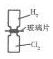 利用如图装置可将H2和Cl2均匀混合 | |
| B. | 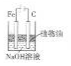 利用如图装置可以制备能较长时间存在的Fe(OH)2沉淀 | |
| C. |  利用如图装置加热蒸干NaCl溶液制备NaCl晶体 | |
| D. |  利用如图装置分离苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①发生了氧化还原反应 | |
| B. | ①变灰暗是因为生成了过氧化钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④⑤只发生物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com