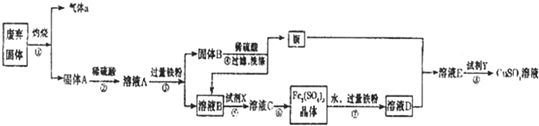
解答:解:(1)K=
;K(300℃)>K(350℃),升高温度时,生成物的浓度降低,平衡向逆反应方向移动,升高温度,平衡向吸热方向移动,所以逆反应是吸热反应,正反应是放热反应.
故答案为:K=
;放热.
(2)NO
2是生成物,所以开始浓度为0,故排除c、d;该反应中一氧化氮、二氧化氮的计量数之比为1:1,所以达平衡时其浓度该变量为1:1,一氧化氮浓度的改变量是0.0065mol/L,所以二氧化氮浓度的改变量是0.0065mol/L,所以b正确.
0~2s内一氧化氮的平均反应速率v=
=mol/Ls=0.003mol/L.s,同一反应中,各物质的反应速率之比等于计量数之比,所以在0~2s内氧气的反应速率为1.5×10
-3mol/(L?s).
故答案为:b;1.5×10
-3 mol/(L?s).
(3)A、无论反应是否达到平衡状态,v(NO
2)=2v(O
2)始终存在,故A错误.
B、该反应是气体体积变化的反应,所以该反应 受压强的影响,只要压强不再变化,反应就达平衡状态,故B正确.
C、v
正(NO)=2v
正(O
2),反应指同一方向,故C错误.
D、根据质量守恒,反应前后质量不变,容器的体积不变,所以密度始终不变,故D错误.
故选B.
(4)A、升高温度,平衡向逆反应方向移动,所以平衡时c(NO)增大,故A错误.
B、恒温恒压下再充入0.01molNe,减小了反应体系的压强,平衡向 逆反应方向移动,但因为体积增大平衡时c(NO)减小,故正确.
C、恒温体积缩小一半,增大了反应体系的压强,平衡向正反应方向移动,但因为体积减小达平衡时c(NO)增大,故C错误.
D、恒温恒容下再加入0.01mol O
2,平衡向正反应方向移动,所以平衡时c(NO)减小,故D正确.
故选BD.
(5)A、升高温度,平衡向逆反应方向移动,所以平衡时c(NO)增大,故A错误.
B、恒温恒压下再充入0.01molNe,减小了反应体系的压强,平衡向 逆反应方向移动,但因为体积增大平衡时c(NO)减小,故正确.
C、恒温体积缩小一半,增大了反应体系的压强,平衡向正反应方向移动,但因为体积减小达平衡时c(NO)增大,故C错误.
D、恒温恒容下再加入0.01mol O
2,平衡向正反应方向移动,所以平衡时c(NO)减小,故D正确.
故选BD.

 在2L密闭容器中,800℃时反应2NO(g)+O2(g)
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:


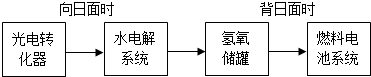
 2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为
2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为