
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,含有自由移动电子或离子的物质能导电;
(2)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,所以铜是还原剂、部分硝酸是氧化剂,还原剂发生氧化反应、氧化剂发生还原反应,以此来解答.
解答 解:(1)②④⑦在水溶液里或熔融状态下能电离出阴阳离子而使其水溶液或熔融状态导电,所以属于电解质;
①的水溶液能电离出阴阳离子的是碳酸,所以二氧化碳是非电解质,⑧蔗糖在水溶液里或熔融状态下以分子存在,所以其水溶液或熔融状态不导电,为非电解质;
③⑦中含有自由移动的离子,⑥中含有自由移动的电子,所以能导电;
氨水是混合物,铜是单质,所以氨水和铜既不是电解质也不是非电解质,故答案为:②④⑦;③⑥⑦;
(2)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,则配平方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,Cu元素失电子被氧化,该反应中铜是还原剂,则氧化产物是Cu(NO3)2,N元素得到电子,则HNO3为氧化剂,由电子守恒可知还原剂与氧化剂的物质的量之比为之比是=3:2,所以硝酸表现的性质有酸性和氧化性;
故答案为:3,8,3,2,4; 酸性和氧化性;3:2.
点评 本题考查了电解质和非电解质的判断、氧化还原反应,为高频考点,注意从元素化合价变化来分析解答,侧重分析与计算能力的综合考查,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
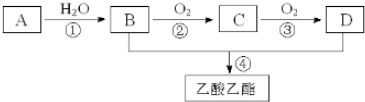
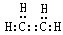 .
. ,取代反应.
,取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )| A. | 在a点,溶液pH>1 | |
| B. | 在b点,CH3COOH的Ka≈c(H+) | |
| C. | 在c点,c(CH3COO-)=c(Na+)=0.1 mol•L-1 | |
| D. | 在d点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O6 | D. | Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | |
| B. | X2为0.15 mol•L-1,Z为0.1 mol•L-1 | |
| C. | c(X2)+c(Y2)+c(Z)=0.6 mol•L-1 | |
| D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{3b}{0.0224V}$ | B. | e=a+$\frac{8cV}{1000}$ | C. | d=a+$\frac{17cV}{1000}$ | D. | $\frac{82a}{65}$<e<$\frac{5a}{4}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com