
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:HCl>H2 S>PH3 | ||
| C. | 酸性强弱:HClO4>H2 SO4>H3PO4 | D. | 熔点:Na>SiO2>CO2 |
分析 A、同周期元素从左到右金属性逐渐减弱;
B、非金属性越强,气态氢化物越稳定;
C、非金属越强,则其最高价氧化物的水化物的酸性越强;
D、晶体熔沸点:原子晶体>离子晶体>分子晶体.
解答 解:A、同周期元素从左到右金属性逐渐减弱,则有金属性强弱:Na>Mg>Al,故A正确;
B、非金属性Cl>S>P,气态氢化物的稳定性为HCl>H2S>PH3,故B正确;
C、非金属越强,则其最高价氧化物的水化物的酸性越强,非金属性:P<S<Cl,则酸性:H3PO4<H2SO4<HClO4,故C正确;
D、晶体熔沸点:原子晶体>离子晶体>分子晶体,钠的熔沸点较低,所以熔沸点SiO2>Na,故D错误;
故选D.
点评 本题考查元素周期律,侧重考查学生分析推断能力,知道非金属性强弱判断方法、晶体熔沸点高低判断方法.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用二氧化硅与烧碱反应制备硅酸钠:SiO2+OH-═SiO32-+H2O | |
| C. | 用铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯气制备漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
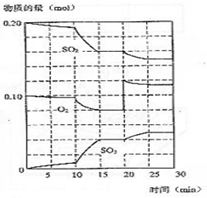 在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0
在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol(L•min) | |
| B. | C的平衡浓度为2mol/L | |
| C. | 平衡后,增大压强,平衡将向正方向移动 | |
| D. | 若单位时间内生成的B和C的物质的量之比为3:2,则体系处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | CaO的量减少 | C. | 氧气浓度变大 | D. | CaO2的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
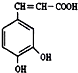 如图咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
如图咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.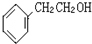 .
. 的一种同分异构体,A的苯环上有三个取代基,能发生银镜反应,苯环上的一氯代物有两种.写出A的一种结构简式:
的一种同分异构体,A的苯环上有三个取代基,能发生银镜反应,苯环上的一氯代物有两种.写出A的一种结构简式: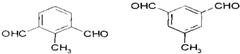 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com