
在一定条件下,某化合物W受热分解:2W A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )
A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )
A. 11.43 B. 22.86g/mol C. 80.01 D. 80.01g/mol
考点: 化学方程式的有关计算.
分析: 令W的物质的量为2mol,由方程式可知混合气体总物质的量为7mol,根据混合气体相对氢气密度计算混合气体的平均摩尔质量,根据m=nM计算混合气体总质量,由质量守恒定律可知W的质量等于混合气体总质量,再根据M= 计算W的摩尔质量.
计算W的摩尔质量.
解答: 解:令W的物质的量为2mol,由方程式2W A↑+2B↑+4C↑,可知混合气体总物质的量为1mol+2mol+4mol=7mol,
A↑+2B↑+4C↑,可知混合气体总物质的量为1mol+2mol+4mol=7mol,
混合气体对氢气的相对密度为11.43,则混合气体平均摩尔质量=2g/mol×11.43=22.86g/mol,混合气体总质量=7mol×22.86g/mol,由质量守恒定律可知W的质量等于混合气体总质量,故W的摩尔质量=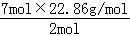 =80.01g/mol,
=80.01g/mol,
故选D.
点评: 本题考查物质的量计算、化学方程式计算,难度不大,关键是理解相同条件下气体的摩尔质量和气体的密度成正比,注意掌握摩尔质量的计算方法.


科目:高中化学 来源: 题型:
表是元素周期表的一部分,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素符号:① ;⑥ .
(2)画出⑤原子的结构示意图: .
③和⑧元素形成的化合物中含 键.(写化学键类型)
(3)在①﹣﹣⑨的元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 .(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是
(5)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),用一化学反应方程式表达这一事实 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
|
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2C02(g)=2CO(g)+02(g)反应的△H=+2×283.0 KJ/mol |
|
| C. | 反应A(s)+B(g)=C(s)+D(s)能自发进行,则一定有△H>0 |
|
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容的密闭容器中,对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是( )
|
| A. | 增大O2的浓度,SO3的化学反应速率减慢 |
|
| B. | 1molSO2与过量的O2反应,一定生成1molSO3 |
|
| C. | 起始投入2molSO2、1molO2与起始投入2molSO3,达到平衡状态时,SO3的体积分数相等 |
|
| D. | 往平衡体系中充入一定量的N2,使体系的压强增大,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于指定粒子构成的叙述中,不正确的是( )
A. 37Cl与39K具有相同的中子数
B. 第114号元素的一种核素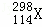 与
与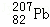 具有相同的最外层电子数
具有相同的最外层电子数
C. O22﹣与S2﹣具有相同的质子数和电子数
D. H3O+与OH﹣具有相同的质子数和电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 只有活泼金属与活泼非金属元素原子之间才能形成离子键
B. Na2O2中阳离子和阴离子个数比为1:1
C. 形成离子键的阴、阳离子间只有静电吸引力
D. 共价键存在于共价化合物中,也可能存在于单质及离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢.
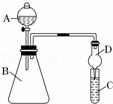
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)检验该装置气密性的操作方法是 ,干燥管D的作用是 .
(2)现有试剂:盐酸、碳酸钙、澄清石灰水、硅酸钠溶液,请从中选择试剂并用如图装置证明酸性:HCl>H2CO3>H2SiO3.则B中应盛装的试剂为 ,C中产生的现象为 有 .请判断 (填“能”或“不能”)根据实验现象判断非金属性:Cl>C>Si.
(3)若C中盛装的是Na2S溶液,A中盛装浓盐酸,B中盛装KMnO4粉末.(KMnO4与浓盐酸常温下快速反应生成氯气)反应开始后观察到C中出现淡黄色浑浊,可证明Cl的非金属性比S (填“强”或者“弱”或者“无法比较”),写出反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
汞(熔点﹣39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞.目前工业上制粗汞的一种流程图如下.

下列分析错误的是( )
A. “灼烧辰砂法”过程中电子转移的方向和数目可表示为: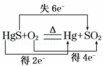
B. 辰砂与氧化钙加热反应时,CaSO4为氧化产物
C. 洗涤粗汞可用5%的盐酸代替5%的硝酸
D. 减压蒸馏的目的是降低汞的沸点,提高分离效率
查看答案和解析>>
科目:高中化学 来源: 题型:
在搪瓷和陶瓷器皿具表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类为防止中毒,不能长期盛放下列物质的是( )
A.食盐 B.酱油 C.蔗糖 D.食醋
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com