
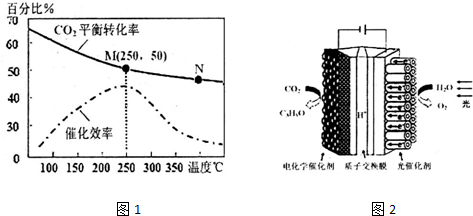
分析 (1)已知:H2(g)的燃烧热为285.8kJ•mol-1,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;CH2=CH2(g)的燃烧热为1411.0kJ•mol-1,其热化学方程式为:C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;H2O(g)=H2O(l)△H=-44.0kJ•mol-1,结合盖斯定律计算;
(2)①温度升高化学反应速率加快,催化剂的催化效率降低;
②该反应是放热反应,升温平衡逆向移动;
③反应是放热反应,温度升高平衡逆向进行;
④温度越低催化剂活性越小,反应速率越慢;
⑤增大压强化学平衡向气体体积减小的方向移动;
(3)由装置图可知,阴极上CO2得电子C3H8O.
解答 解:(1)已知:H2(g)的燃烧热为285.8kJ•mol-1,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol①;
CH2=CH2(g)的燃烧热为1411.0kJ•mol-1,其热化学方程式为:C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol②;
H2O(g)=H2O(l)△H=-44.0kJ•mol-1③;
利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)?CH2═CH2(g)+4H2O(g)△H=-127.8kJ•mol-1;
故答案为:-127.8;
(2)①化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故①不正确;
②温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故②不正确;
③升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故③正确;
④为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故④不正确;
⑤增大压强化学平衡向气体体积减小的方向移动,即向正方向移动,所以增大压强可提高乙烯的体积分数,故⑤正确;
故答案为:①②④;
(3)由装置图可知,阴极上CO2得电子C3H8O,则阴极上发生电极反应式为3CO2+18H++18e-=C3H8O+5H2O;
故答案为:3CO2+18H++18e-=C3H8O+5H2O.
点评 本题考查了热化学方程式书写、盖斯定律的应用、原电池和电解池原理的理解应用,注意化学方程式书写方法,题目难度中等,侧重于考查学生的分析能力和计算能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①②④ | C. | ②③ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sn(NO3)4 | B. | Sn(NO3)2 | C. | SnO2?4H2O | D. | SnO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,C(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的① 溶液②CH3COONa溶液中的c(Na+):①>② 溶液②CH3COONa溶液中的c(Na+):①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH可用于治疗胃酸过多 | |
| B. | CaO可防止月饼等食品氧化变质 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 向海水中加入净水剂明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D
;D .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com