
 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测的实验现象 |
| A | 浓盐酸 | 二氧化锰固体 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生白色沉淀 |
| D | 稀硫酸 | 滴有石蕊的亚硫酸钠溶液 | 溶液逐渐变红 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸与二氧化锰反应需要加热;
B.常温下,浓硝酸和铝发生钝化现象;
C.NaOH过量,开始不生成沉淀;
D.稀硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫的水溶液呈酸性.
解答 解:A.浓盐酸与二氧化锰反应需要加热,图中没有加热,则不能反应生成气体,故A错误;
B.常温下,Al遇浓硝酸发生钝化,则不能观察到红棕色气体,现象不合理,故B错误;
C.NaOH过量,开始不生成沉淀,反应生成偏铝酸钠和氯化钠,开始无现象,故C错误;
D.稀硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫的水溶液呈酸性,石蕊变红色,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质和反应现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
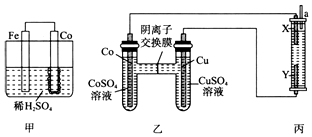 钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:
钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 800 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ⑤ | C. | ④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 将CO2(含HC1杂质)通入饱和NaHCO3溶液中 | 除去HC1 |
| B | 向做完银镜反应后的试管中加入稀氨水 | 除去试管内残留物 |
| C | 向食盐溶液中滴加少量淀粉溶液 | 鉴别真假碘盐 |
| D | 将少量FeC12试样加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 检验FeCl2试样是否变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和 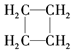 互为同系物 互为同系物 | |
| D. | 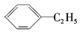 和 和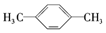 互为同分异构体 互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com