
下列离子方程式中正确的是( )
A.实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-====Cl-+HClO
B.向AlCl3溶液中滴加过量氨水制备Al(OH)3:
Al3++3NH3·H2O====Al(OH)3↓+3NH4+
C.用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用FeCl3溶液腐蚀铜制印刷电路板:Fe3+ +Cu====Fe2++Cu2+
+Cu====Fe2++Cu2+
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
在一定条件下,RO3n-与氟气可发生如下反应: RO3n—+ F2 + 2OH- = RO4—+ 2F- + H2O
从而可知在RO3n-中,元素R的化合价是( )
A、+4 B、+5 C、+6 D、+7
查看答案和解析>>
科目:高中化学 来源: 题型:
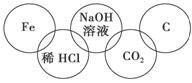
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能
发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有 ( )。
A.复分解反应、1个 B.分解反应、2个
C.化合反应、3个 D.置换反应、2个
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.含氧酸起氧化作用,无氧酸则不能 B.还原剂在反应中得电子
C.还原剂在反应中发生氧化反应 D.氧化剂在同一反应中既可以是反应物,也可以是生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O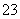 +O2+xOH-===Fe3O4+S4O
+O2+xOH-===Fe3O4+S4O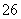 +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________。(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.平衡常数的大小不能反映化学反应可能进行的程度
B.K值越小,反应物的转化率越大
C.K值越大,反应物的转化率越大
D.温度越高,K值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)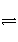
 P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c0(M)=1 mol·L-1,c0(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率________(填“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c0(M)=4 mol·L-1,c0(N)=a mol·L-1;达到平衡后,[P]=2 mol·L-1,a=________;
(4)若反应温度不变,反应物的起始浓度为:c0(M)=c0(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)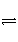
 CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有H原子个数将酸分为一元酸、二元酸等
②碱性氧化物一定是金属氧化物
③根据丁达尔现象可将分散系分为胶体、溶液和浊液
④SiO2是酸性氧化物,能与NaOH溶液反应
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A. ②③ B.②④⑤ C.①②④ D.②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com