
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42-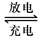 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 , 电解液中H2SO4的浓度将变________,当外电路通过2mol电子时,理论上负极板的质量增加 g。
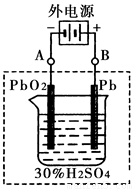
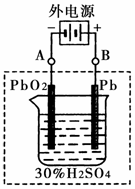
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板 按下图连接,电解一段时间后,则在A电极上生成 __________,B电极上生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
(1)①Pb+SO42- -2e- = PbSO4
小 96
②Pb; PbO2;
(2)cd
解析试题分析:(1)①Pb+PbO2+4H++2SO42-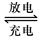 2PbSO4+2H2O,该反应中Pb作为负极,所以负极的电极反应式是Pb+SO42- -2e- = PbSO4 ,反应过程中消耗了硫酸,所以电解液中H2SO4的浓度将变小;该反应转移的电子数为2,所以当外电路通过2mol电子时,即有1mol的Pb发生反应,所以在负极增加一摩尔硫酸根的质量,即负极板的质量增加96g;②该过程为放电的逆过程,所以在A电极上生成Pb,在B电极上生成PbO2;(2)阳极发生的是氧化反应,所以不能用铁作阳极材料,a错误;阳极反应方程式为:2Cl--2e-=Cl2↑,Cl2在弱碱性条件下生成ClO-,故电解过程中阳极附近溶液的pH降低,所以b错误,c正确,1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故d正确,本题答案选择cd。
2PbSO4+2H2O,该反应中Pb作为负极,所以负极的电极反应式是Pb+SO42- -2e- = PbSO4 ,反应过程中消耗了硫酸,所以电解液中H2SO4的浓度将变小;该反应转移的电子数为2,所以当外电路通过2mol电子时,即有1mol的Pb发生反应,所以在负极增加一摩尔硫酸根的质量,即负极板的质量增加96g;②该过程为放电的逆过程,所以在A电极上生成Pb,在B电极上生成PbO2;(2)阳极发生的是氧化反应,所以不能用铁作阳极材料,a错误;阳极反应方程式为:2Cl--2e-=Cl2↑,Cl2在弱碱性条件下生成ClO-,故电解过程中阳极附近溶液的pH降低,所以b错误,c正确,1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故d正确,本题答案选择cd。
考点:原电池、电解池
点评:本题考查了原电池、电解池的知识,该考点是高考考查的重点和难点,本题有一定的综合性,难度适中。


科目:高中化学 来源: 题型:
 (1)铅蓄电池的电池总反应式为:
(1)铅蓄电池的电池总反应式为:| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源:2014届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42-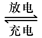 2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 , 电解液中H2SO4的浓度将变________,当外电路通过2mol电子时,理论上负极板的质量增加 g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板 按下图连接,电解一段时间后,则在A电极上生成 __________,B电极上生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省威海市高二(上)期末化学试卷(解析版) 题型:解答题
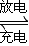 2PbSO4+2H2O回答下列问题.(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题.(不考虑氢、氧的氧化还原)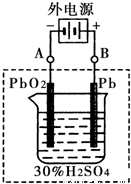
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- ![]() 2PbSO4+2H2O回答下列
2PbSO4+2H2O回答下列
 |
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 ,
电解液中H2SO4的浓度将变________,当外电路通过
2mol电子时,理论上负极板的质量增加 g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板
按右图连接,电解一段时间后,则在A电极上生成 __________,B电极上?生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com