
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
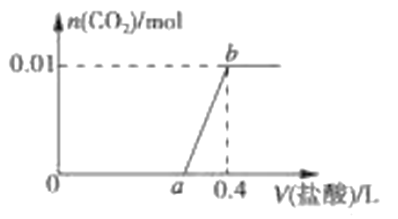
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
【答案】C
【解析】
向氢氧化钠和碳酸钠混合溶液中滴加稀盐酸,盐酸会先与氢氧化钠反应,再与碳酸钠反应。盐酸与碳酸钠反应分为两步,首先盐酸与碳酸钠反应生成碳酸氢钠和氯化钠,然后盐酸与碳酸氢钠反应生成二氧化碳、氯化钠和水,据此解答。
反应方程式依次如下:
①HCl+NaOH=NaCl+H2O;
②HCl+Na2CO3=NaHCO3+NaCl;
③HCl+NaHCO3=NaCl+CO2↑+H2O。
A. a点以后开始生产二氧化碳气体,则0~a范围内发生的化学反应为①和②,不仅仅是酸碱中和反应,故A项错误;
B. ab段为生成二氧化碳的过程,发生反应的化学方程式为③,故其离子方程式为HCO3-+H+=CO2↑+H2O,故B项错误;
C. 由图可知生成二氧化碳0.01 mol,根据碳元素守恒,则混合物中碳酸钠的物质的量是0.01 mol,所以两步反应②、③消耗的盐酸的量均是0.01 mol,则稀盐酸的体积均是0.01mol÷0.1mol/L=0.1 L,故a=0.4-0.1=0.3,故C项正确;
D. 根据碳元素守恒可知,混合物中Na2CO3的物质的量等于生成的CO2的物质的量,为0.01 mol,因0~a(0~0.3)阶段消耗的盐酸的总的物质的量为0.3 L×0.1mol/L=0.03 mol,发生反应②碳酸钠消耗的盐酸的物质的量为0.01 mol,则反应①中氢氧化钠消耗的盐酸为0.03 mol-0.01 mol=0.02 mol,即氢氧化钠的物质的量为0.02 mol,从而可得原混合溶液中NaOH和Na2CO3的物质的量之比为2:1,故D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
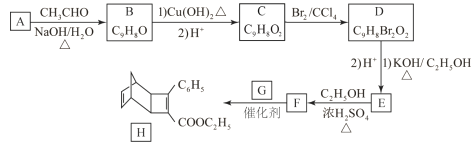
已知:①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)A的化学名称为为__________。
(2)由C生成D的反应类型为__________。
(3)E的结构简式为______________________________。
(4)写出用环戊烷和2-丁炔为原料制备化合物 的合成路线 (其他试剂任选)。______ 。
的合成路线 (其他试剂任选)。______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的溶液中,能大量共存的离子组是
A.Na+、Mg2+、H+、OH-B.H+、Al3+、AlO2-、CO32-
C.H+、Fe3+、Cl-、SiO32-D.K+、Ca2+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去。又知A为高熔点物质,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料。试回答:
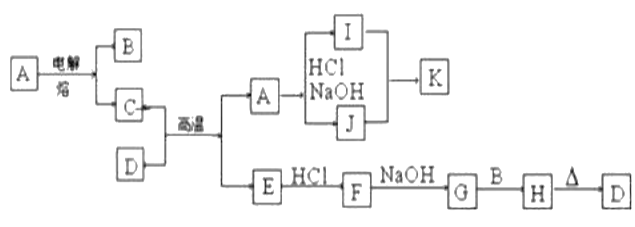
(1)写出下列物质的化学式:I____________,F____________。
(2)G转化为H的现象是____________,对应化学方程式为____________。
(3)写出I和J反应生成K的离子方程式____________。
(4)写出C+D→A+E的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
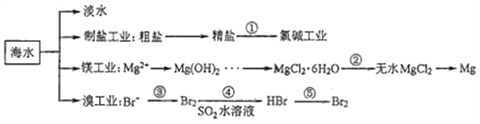
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)

A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式中不正确的是
A. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH—=SiO32—+H2O
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I—+H2O2=I2+2H2O
C. 燃煤时加入适量石灰石粉末,可减少SO2的排放:2CaCO3+2SO2+O2![]() 2CaSO4+2CO2
2CaSO4+2CO2
D. 强碱溶液中,用次氯酸钠与Fe(OH)2反应制备高铁酸钠:2ClO—+ Fe(OH)2=FeO42—+2Cl—+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com